本试卷有19道题,考试时长90分钟,满分100分。
可能用到的相对原子质量:H1 Cl2 O16 S32 K39 Fe56 Cu64 I 127
第一部分(共42分)
本部分共14道小题,每小题3分,共42分。每小题选出最符合题目要求的一项。
1. 下列生活中常见的现象中,其反应原理不涉及氧化还原反应的是
A. 铁的冶炼 | B. 电池放电 | C. 碳酸氢钠作发酵粉 | D. 天然气燃烧 |
|
|
|
|
2. 苯丙炔酸(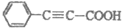 )广泛用于医药、香料等化工产品中。下列关于苯丙炔酸的说法正确的是
)广泛用于医药、香料等化工产品中。下列关于苯丙炔酸的说法正确的是
A. 分子式为C9H7O2
B. 与丙炔酸(CH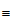 C-COOH)互为同系物
C-COOH)互为同系物
C. 是高分子化合物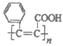 的单体
的单体
D. 1 mol苯丙炔酸最多可与6 mol氢气发生反应
3. 下列说法正确的是
A. 乙醇的沸点低于丙烷
B. 对甲基苯酚( )加入浓溴水易发生取代反应
)加入浓溴水易发生取代反应
C. CH2=C(CH3)2的名称是2-甲基-2-丙烯
D. 对二甲苯的核磁共振氢谱有3个吸收峰
4. 下列说法正确的是
A. 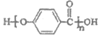 的结构中含有酯基
的结构中含有酯基
B. 顺-2-丁烯和反-2-丁烯的加氢产物不同
C. 1 mol葡萄糖可水解生成2 mol乳酸(C3H6O3)
D. 油脂和蛋白质都是能发生水解反应的高分子化合物
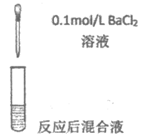
5. 将SO2分别通入下列4种溶液中,有关说法正确的是
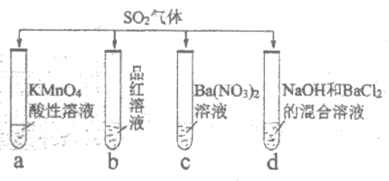
A. 试管a中实验可以证明SO2具有漂白性
B. 试管b中溶液褪色,说明SO2具有强氧化性
C. 试管c中能产生白色沉淀,说明SO2具有还原性
D. 试管d中能产生白色沉淀,该沉淀完全溶于稀硝酸
6. 下列表示对应化学反应的离子方程式正确的是
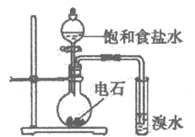
A. 用石墨电极电解饱和食盐水:2Cl–+2H2O=2OH–+H2↑+Cl2↑
B. 向稀NaHCO3中加入过量Ca(OH)2溶液:
2HCO3–+Ca2++2OH–=CaCO3↓+2H2O+CO32-
C. 用Na2CO3溶液预处理水垢中的CaSO4:CO32-+CaSO4=CaCO3↓+SO42-
D. 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O
7. 化学反应中,反应物用量或浓度可能对最终生成物产生影响。下列反应的生成物不受上述因素影响的是
A. 铜与硝酸反应
B. 苯酚钠溶液与二氧化碳反应
C. 铁与稀硝酸反应
D. 碳酸钠溶液与盐酸反应
8. 下列颜色变化与氧化还原反应无关的是
A. 湿润的红色布条遇氯气褪色
B. 往沸水中加入棕黄色FeCl3饱和溶液,溶液变为红褐色
C. 紫色酸性KMnO4溶液通入乙烯气体后褪色
D. 浅黄色Na2O2固体露置于空气中逐渐变为白色
9. 可用于检测CO的某气敏传感器的工作原理如图所示。下列说法不正确的是
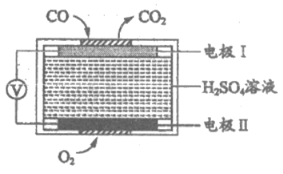
A. 工作过程中化学能转化为电能
B. 工作一段时间后溶液的pH几乎不变
C. 电极I上发生反应:CO-2e–+H2O=CO2+2H+
D. 电极Ⅱ上发生反应:O2+2H2O+4e–=4OH–
10. 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,原理示意图如下。经过一段时间后,有Cr(OH)3和Fe(OH)3沉淀随废水排出,从而使废水中铬含量低于排放标准。下列说法不正确的是
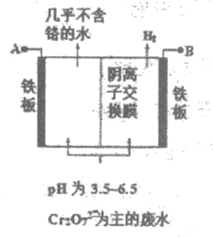
A. 阴极区发生的电极反应包括:2H++2e–=H2↑
B. 还原Cr2O72-的主要方式是
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
C. 废水的pH过高或过低均会降低铬的去除率
D. 电解工作时,Cr2O72-通过阴离子交换膜从阳极室进入阴极室
11. 下列图示的实验设计能实现相应实验目的的是
A. 验证FeCl3溶液中是否含有Fe2+ | B. 检验溴乙烷消去的产物 |
|
|
C. 检验氯气与亚硫酸钠是否发生反应 | D. 证明乙炔可使溴水褪色 |
|
|
12. “空气吹出法”海水提溴的工艺流程如下:
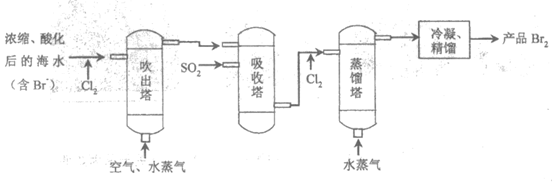
下列说法不正确的是
A. 进入吹出塔前,Br–被氧化为Br2
B. 从吸收塔流出的溶液主要含HBr和H2SO4
C. 经过吸收塔后,溴元素得到富集
D. 两次通入水蒸气的作用都是参加反应
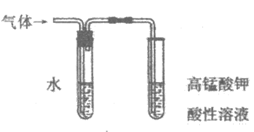
13. 为探究SO2与Fe3+间是否发生氧化还原反应,按下图装置进行实验(夹持、加热仪器略),下列说法不正确的是
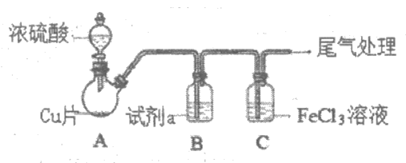
A. A中的反应体现了浓硫酸的氧化性和酸性
B. 试剂a不能使用饱和 NaHCO3溶液
C. C中溶液pH降低,可证明Fe3+氧化了SO2
D. 尾气可用NaOH溶液吸收
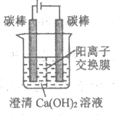
14. 某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号 | ① | ② | ③ |
装置 |
|
|
|
现象 | 小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 | 两极均产生气泡,溶液无明显变化 | 两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 |
下列说法正确的是
A. ①中小灯泡微亮是因为Ca(OH)2是弱电解质
B. 对比①和②,白色浑浊的出现与电极材料无关
C. 对比①和③,白色浑浊是由于OH–迁移到阳极使Ca(OH)2沉淀析出
D. 阳极附近白色沉淀的成分可能是CaCO3
第二部分(共58分)
15.(10分)工业上用菱锰矿(MnCO3)[含FeCO3、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
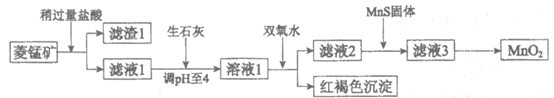
已知:
生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1 mol/L
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是________。
(2)向溶液1中加入双氧水时,反应的离子方程式是________。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,用沉淀溶解平衡解释加入难溶电解质MnS的作用________。
(4)制备MnO2的另一种方法是电解法。用惰性电极电解MnCl2溶液可以制得MnO2。
①生成MnO2的电极反应式是________。
②若直接电解MnCl2溶液,生成MnO2的电极上同时会产生少量气体。用电极反应式解释产生此气体的原因________。
16. (8分)地球上的氮元素对动植物有重要作用,其中氨的合成与应用是当前研究热点。
(1)人工固氮最主要的方法是Haber-Bosch法。通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨,写出此反应方程式________。
(2)常温常压下电解法合成氨的原理如下图所示:
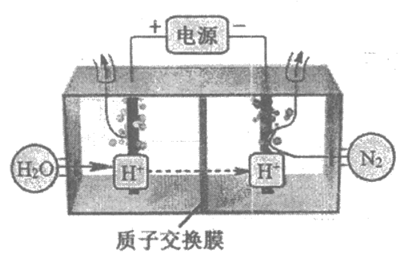
①阴极生成氨的电极反应式为________。
②阳极氧化产物只有O2。电解时实际生成的NH3的总量远远小于由O2理论计算所得NH3的量,结合电极反应式解释原因:________。
(3)氨是生产氮肥的原料,经如下转化可以得到NH4NO3。
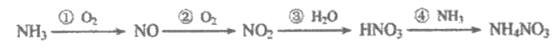
已知:氮原子利用率是指目标产物中氮的总质量与生成物中氮的总质量之比。
上述反应③的氮原子利用率为66.7%。要使原料NH3转化为NH4NO3的整个转化过程中氮原子利用率达到100%,可采取的措施是________。
17.(14分)高分子H是人造棉的成分之一,其合成路线如下:
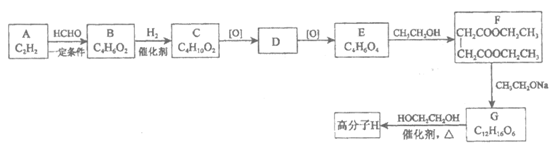
已知:i. R1COOR2+R3CH2COOR4
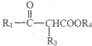 +R2OH
+R2OH
ii. RCOOR’+R”OH RCOOR”+R’OH
RCOOR”+R’OH
(R1、R2、R3、R4、R、R’、R”代表烃基)
(1)按官能团分类,A的类别是________。
(2)B为不饱和醇,A→B的反应类型是________。
(3)C物质的系统命名名称为________。
(4)检验D中官能团的试剂是________。
(5)E→F的化学方程式是________。
(6)G分子内含有一个六元环(含” “结构)。
“结构)。
①下列试剂能使CH3CH2OH转化为CH3CH2ONa的是________(填序号)。
a. Na b. NaOH c. NaHCO3
②G→H的反应类型为缩聚反应,该反应还有CH3CH2OH生成,其化学方程式是______。
18.(10分)高铁酸钾(K2FeO4)是一种新型的污水处理剂。
(1)K2FeO4的制备
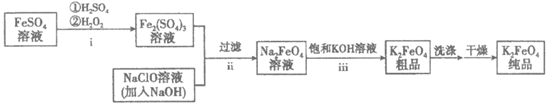
①将ii中反应的离子方程式补充完整:

②iii中反应说明溶解度:Na2FeO4________K2FeO4(填”>”或”<”)。
(2)K2FeO4的性质和应用
i. 将K2FeO4固体溶于蒸馏水中,有少量无色气泡产生,经检验为O2,液体有丁达尔效应。
ii. 将K2FeO4固体溶于浓KOH溶液中,放置2小时无明显变化。
iii. 将K2FeO4固体溶于硫酸中,产生无色气泡的速率明显比i快。
①K2FeO4溶于蒸馏水的化学反应方程式是________。
②K2FeO4可用于生活垃圾渗透液的脱氮(将含氮物质转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如下:
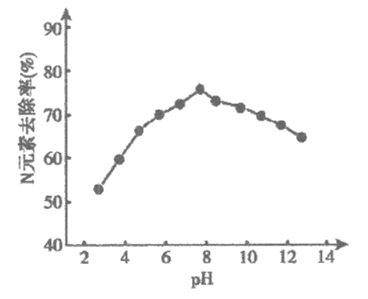
根据上图推测,pH=4时生活垃圾渗透液中含氮物质主要以________形式存在。pH大于8时,脱氮效果随pH的升高而减弱,分析可能的原因:_________。
19.(16分)某小组进行了验证反应”Fe+2Ag+=Fe2++2Ag”的实验:向硝酸酸化的0.05mol/L硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验反应的产物。
①检验Fe2+:方法是_________。
②检验Ag:取出少量黑色固体,加足量稀HNO3并加热,固体全部溶解并在液面上方试管口处观察到红棕色气体,产生此气体的化学反应方程式是_________。甲同学认为此实验不能说明黑色固体含有Ag,他补充了一个实验后确认黑色固体含Ag,他的实验方案是_________。
(2)针对”溶液呈黄色”的异常现象进行探究。
①甲同学根据试剂用量,认为溶液中不可能有Fe3+,甲依据的原理是_________。(用离子方程式表示)。
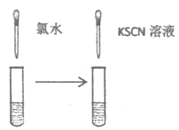
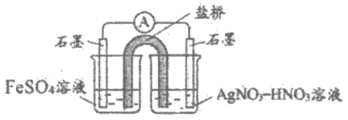
②乙同学取上层清液,滴加KSCN溶液,溶液变红,产生白色沉淀(经检验,白色沉淀为AgSCN),证实了溶液中含有Fe3+。乙同学提出假设:溶液中存在Ag+,可氧化Fe2+。并设计下图实验验证假设是正确的。实验现象为_________。
③丙同学还提出了不同的看法,认为空气和酸性条件下的NO3–也可能氧化Fe2+。反应的离子方程式为:
4Fe2++O2+4H+=4Fe3++2H2O、_______。乙同学又设计了如下实验,证明了Ag+氧化Fe2+是产生Fe3+的主要原因:向_______中加入过量铁粉,往上层清液中滴加KSCN后溶液颜色基本无变化。
④乙同学还发现:白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样的时刻有关。实验过程和现象如下
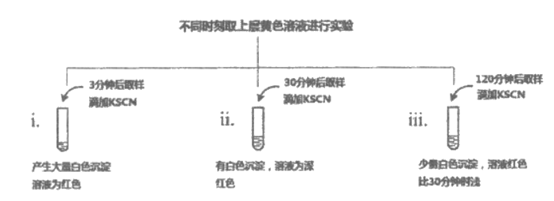
根据上述所有实验,解释实验i~iii中Fe3+浓度随时间而变化的原因:________。
参考答案
每个选择3分
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
答案 | C | C | B | A | C | C | B |
题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | B | D | D | B | D | C | D |
每空2分
15.(10分)
(1)增大接触面积,提高反应速率
(2)2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+
(3)MnS(s)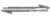 Mn2+(aq)+S2-(aq),S2-+Cu2+=CuS↓,生成更难溶的CuS,降低c(S2-),使平衡正向移动,MnS转化为Cus,除去Cu2+。
Mn2+(aq)+S2-(aq),S2-+Cu2+=CuS↓,生成更难溶的CuS,降低c(S2-),使平衡正向移动,MnS转化为Cus,除去Cu2+。
(4)①Mn2+-2e–+2H2O=MnO2+4H+ ②2Cl–-2e–=Cl2
16.(8分)
(1)N2+3H2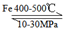 2NH3
2NH3
(2)①N2+6H++6e–=2NH3
②阴极一定有其他微粒放电,2H++2e–=H2↑
(3)将生成的NO循环利用(或通入足量O2)
17.(14分)
(1)炔烃
(2)加成反应
(3)1,4-丁二醇
(4)新制氢氧化铜悬浊液或者银氨溶液
(5)

(6)①a
②

18.(10分)(1)① 2 10 3 2 3C1– 5H2O;
②>
(2)4K2FeO4+10H2O=4Fe(OH)3(胶体)+3O2↑+8KOH
(3)NH4+
pH>8的溶液,随pH增大,K2FeO4氧化性弱,不利于将含氮物质氧化。
19.(10分)
(1)①取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,证明有Fe2+。
②2NO+O2=2NO2。
取加HNO3后所得溶液少量于试管中,加少量盐酸,产生白色沉淀,证明黑色固体有Ag。
(2)①Fe+2Fe3+=3Fe2+
②电流计指针偏转,右侧石墨电极上有(Ag)固体吸附
③NO3–+3Fe2++4H+=NO↑+3Fe3++2H2O
硝酸酸化的0.05 mol·L-1 NaNO3溶液(pH≈2)
④溶液中存在反应:①Fe+2Ag+=Fe2++2Ag,②Ag++Fe2+=Ag+Fe3+,③Fe+2Fe3+=3Fe2+。反应开始时,c(Ag+)大,以反应①、②为主,c(Fe3+)增大。约30分钟后,c(Ag+)小,以反应③为主,c(Fe3+)减小。