本试卷有2道大题,考试时长90分钟,满分100分。
可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16
一、选择题(共30题,每小题1分,共30分;每题只有一个正确答案)
1. 下列生活场景涉及化学变化的是

2. 下列气体能供给动植物呼吸的是
A. CO2 B. H2 C. O2 D. N2
3. 地壳中含量最多的元素是
A. O B. Si C. Al D. Fe
4. 下列含金属元素的物质是
A. H2S B. P2O5 C. CaCO3 D. H2O
5. 加碘盐中的”碘”指的是
A. 碘单质 B. 碘原子 C. 碘分子 D. 碘元素
6. 下列物质的用途中,利用其化学性质的是
A. 活性炭可用于净水 B. 氧气可用于医疗急救
C. 液氮可用作冷冻剂 D. 稀有气体用于霓虹灯
7. 下列物质的用途中,利用其物理性质的是
A. 铜用于制作导线 B. 氮气用于食品防腐
C. 天然气用作燃料 D. 氧气用于气焊
8. 下列符号能表示2个氧原子的是
A. 2O2 B. O2 C. 2O D. 2O2-
9. 下列物质含有氢分子的是
A. H2 B. H2O2 C. H2CO3 D. H2O
10. 下列物质在空气中燃烧,有大量白烟产生的是
A. 铁丝 B. 红磷 C. 木炭 D. 硫粉
11. 下列物质属于纯净物的是
A. 澄清石灰水 B. 洁净的空气 C. 人呼出的气体 D. 高锰酸钾
12. 下列实验操作中,正确的是
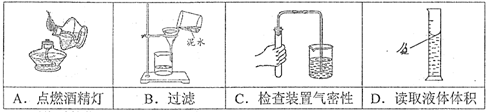
13. 下列物质的化学式书写不正确的是
A. 氢气 H2 B. 高锰酸钾 KMnO4
C. 氧化铁 FeO D. 五氧化二磷 P2O5
14. 一种碳原子的原子核里有6个质子和8个中子,该原子的核外电子数为
A. 6 B. 8 C. 14 D. 12
15. 硅在元素周期表中的相关信息如图所示。下列有关说法不正确的是
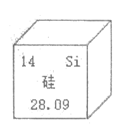
A. 硅的元素符号是Si B. 硅原子的核内质子数为14
C. 硅是金属元素 D. 硅的相对原子质量为28.09
16. 对下列事实解释正确的是
选项 | 事实 | 解释 |
A | 酒香不怕巷子深 | 分子很小 |
B | 一滴水中大约有1.67×1021个水分子 | 分子在不断运动 |
C | 水蒸发变成水蒸气,所占体积变大 | 分子的体积受热膨胀 |
D | 等体积的水和酒精混合后总体积减小 | 分子间有间隔 |
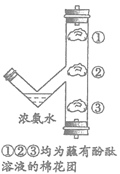
17. 下列方法能鉴别氧气和空气的是
A. 闻气味 B. 加入澄清石灰水
C. 观察颜色 D. 将带火星的木条伸入集气瓶中
18. 下列物质由分子构成的是
A. 氮气 B. 铁 C. 金刚石 D. 氯化钠
19. 下列操作或措施符合实验安全规范的是
A. 将带火星的火柴梗扔进垃圾桶内
B. 酒精洒在桌上燃烧时,立即用湿抹布扑盖
C. 为节省时间直接用手拿块状固体药品
D. 加热高锰酸钾后的试管立即用冷水冲洗
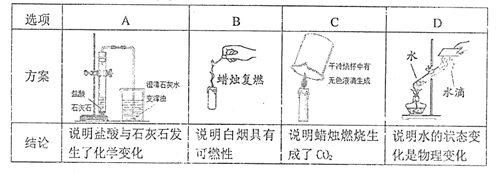
20. 下列实验方案与结论不相对应的是
科学家利用废气中二氧化碳制取燃料甲烷(CH4)的微观示意图如下,根据信息回答21~22题。
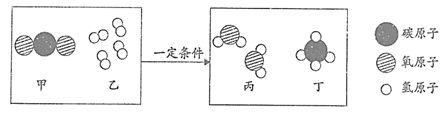
21. 根据微观示意图信息,下列说法不正确的是
A. 丁是甲烷 B. 甲和丙都是氧化物
C. 反应前后,分子的种类不变 D. 反应前后,原子的种类不变
22. 甲烷是天然气的主要成分,下列说法不正确的是
A. 甲烷中含有碳元素和氢元素
B. 甲烷的相对分子质量为16g
C. 甲烷中氢元素质量分数小于碳元素质量分数
D. 1个甲烷分子由1个碳原子和4个氢原子构成
23. 下列属于化合反应的是
A. NH3+HCl===NH4Cl
B. 2KClO3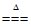 2KCl+3O2↑
2KCl+3O2↑
C. Fe+CuSO4===Cu+FeSO4
D. CuSO4+2NaOH===Na2SO4+Cu(OH)2↓
24. 电解水实验如图。下列说法正确的是
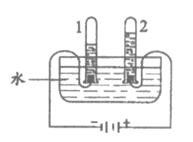
A. 试管2中得到H2
B. 产生H2与O2的体积比约为1:2
C. 该实验说明水由H2和O2组成
D. 可用燃着的木条检验生成的O2
25. 关于净水器(如图)的说法不正确的是
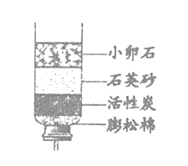
A. 能除去难溶性杂质 B. 不能杀菌消毒
C. 能除去颜色和异味 D. 能得到蒸馏水
26. 下图为尿素[CO(NH2)2]中各元素质量分数的示意图,其中表示碳元素质量分数的是
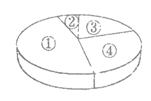
A. ① B. ②
C. ③ D. ④
27. 下列化学方程式书写正确的是
A. C+O2===CO2 B. H2O2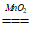 H2↑+O2↑
H2↑+O2↑
C. P+O2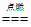 P2O5 D. Fe+CuSO4===FeSO4+Cu
P2O5 D. Fe+CuSO4===FeSO4+Cu
28. 某反应前后分子种类变化的微观示意图如下。下列说法正确的是
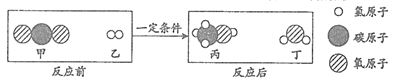
A. 丙的C、H、O原子个数比为1:3:1 B. 反应前后分子总数不变
C. 参加反应的甲、乙的质量比为22:3 D. 该反应属于化合反应
29. 铜可以溶解在稀硝酸中,化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4X,则X的化学式是
A. H2 B. H2O C. H2O2 D. O2
30. 蜡烛在空气中燃烧时,产物为二氧化碳和水,由此可得到关于蜡烛组成元素的推论正确的是
A. 无法推断出蜡烛的组成元素
B. 一定含有C元素,可能含有H、O元素
C. 一定含有C、H元素,可能含有O元素
D. 一定含有C、H、O元素
二、填空题(共70分)(方程式书写2分,其余没有注明的均每空1分)
【生活现象解释】
31. (2分)补齐连线。
32. (9分)了解国际空间站内的”空气”。
(1)站内空气要与地球上的空气组成基本一致,其中O2在空气中的体积分数约为________。
(2)站内O2的来源。
①主要来源是电解水,反应的化学方程式是_______。
②备用O2由分解高氯酸锂( LiClO4)获得,同时还生成氯化锂(LiCl),该反应中含有氧元素的物质(填写化学式)是_________、_________。
(3)过滤器中的活性炭可除去有气味的物质,利用了活性炭的________性。
(4)呼出的二氧化碳用固体氢氧化锂(LiOH)吸收,生成碳酸锂(Li2CO3)和水。
①Li2CO3的相对分子质量为74,其计算式为________。
②反应的化学方程式是_____________。
33. (2分)食品包装袋内常有酒精保鲜片(有效成分C2H5OH),酒精保鲜片以淀粉、二氧化硅( SiO2)为载体,吸附酒精制成。

(1) SiO2属于____________(填序号,下同)。
A. 混合物 B. 单质 C. 氧化物
(2)酒精挥发过程中不发生改变的是____________。
A. 分子的种类 B. 分子间的间隔 C. 分子质量
34. (2分)西城区保健所为每个班级配发了消毒液,如图,其有效成分为次氯酸(HClO)。

(1)次氯酸中,氯元素的化合价为_________________。
(2)次氯酸很不稳定,只存在于水溶液中。在光照的条件下,发生反应:
2HClO 2HCl+O2↑,该反应的基本反应类型为__________。
2HCl+O2↑,该反应的基本反应类型为__________。
【科普阅读理解】
35. (7分)阅读下面科普短文。
葡萄是深受人们喜爱的水果之一,但由于葡萄果皮薄、果肉柔软,难以保存。葡萄的保鲜方法很多,常用的有冰温高湿保鲜法、SO2保鲜法等。
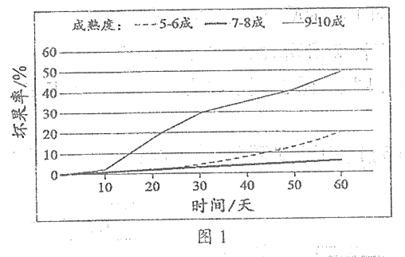
冰温高湿保鲜法。在贮藏过程中,葡萄中的糖(C6H12O6)、VC (C6H8O6)、水分等含量会因温度和湿度的波动而变化。将葡萄贮藏在其冻结点(0℃以下)的范围内、湿度保持在90%以上,能使其生理活性降至最低,从而达到保鲜的目的。采摘时的成熟度对葡萄的保鲜也有一定影响。研究人员以巨峰葡萄为研究对象,将温度和湿度控制在-1.5℃和95%,观察其坏果率(如图1)。
SO2保鲜法。SO2气体对葡萄贮藏中常见的真菌有抑制作用,还能降低葡萄的呼吸强度。但SO2使用时间过长,会对葡萄造成漂白伤害。
表1不同葡萄品种出现漂白伤害的时间(0℃)
红宝石 | 红地球 | 玫瑰香 | 龙眼 | |
时间(天) | 24 | 32 | 58 | 72 |
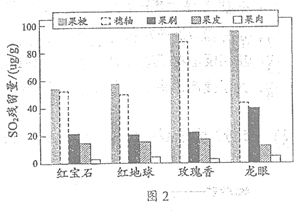
贮藏过程中,SO2会通过不同路径进入葡萄果肉。依据图2果皮中SO2的残留量明显高于果肉,推测出”果皮到果肉”是一条路径。
葡萄的保鲜方法很多,不同地区可根据当地气候、葡萄品种等因素,选择适宜的保鲜方法。
依据文章内容,回答下列问题。
(1)葡萄不易保存的原因是______________(答1条即可)。
(2)葡萄中含有丰富的葡萄糖(C6H12O6)和VC (C6H8O6),两种物质中氧元素含量较高的是______________。
(3)依据图1分析,将温度和湿度控制在-1.5℃和95%的条件下,影响巨峰葡萄坏果率的因素有______________。
(4)由表1可知,在0℃贮藏60天不出现漂白伤害的葡萄品种为____________。
(5)结合图2推测SO2进入果肉的另一路径是_____________(填序号,下同)。
A. 穗轴→果梗→果刷→果肉 B. 果刷→果梗→穗轴→果肉
C. 果梗→穗轴→果刷→果肉
(6)下列说法不正确的是______________。
A. SO2对葡萄的贮藏有益无害 B. 葡萄的保鲜效果与温度、湿度无关
C. 葡萄的保鲜效果与葡萄品种有关
【生产实际分析】
36. (6分)工业上,可以利用甲烷获得氢气,其反应的微观示意图如下:
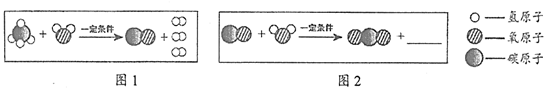
(1)图1所示反应的化学方程式为____________。
(2)在图2横线处补全相应微粒的图示。
(3)在图1、图2所示物质中,属于单质的是______________(填化学式,下同),属于氧化物的是____________。
37. (5分)工业制硝酸的转化流程如下(部分反应条件省略):
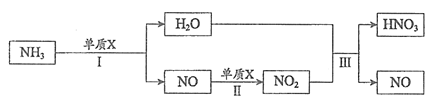
(1)单质X是一种常见气体,其化学式是___________。
(2) II中反应属于基本反应类型中的__________反应。
(3) III中反应在常温下即可发生,反应的化学方程式是___________________。
(4)为了提高氮原子的利用率,可循环利用的物质是________。
38. (5分)利用钛精矿(主要成分为TiO2)制备金属钛(Ti)的主要工艺流程如下:
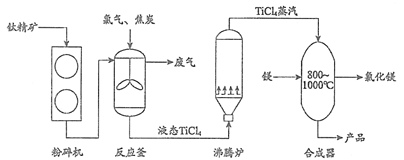
(1) TiO2中钛元素的化合价是____________。
(2)反应釜中搅拌的目的是_________。
(3)推测反应釜废气中含CO,从元素守恒角度说明理由:___________。
(4)合成器中发生反应的化学方程式是____________。
【基本实验及其原理分析】
39. (12分)用下图装置进行实验。
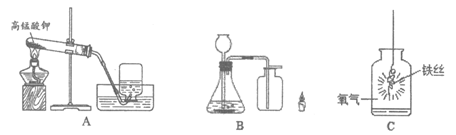
(1)A中反应的化学方程式是_____________,A中棉花的作用是_____________,能用排水法收集氧气的原因是________________。
(2)B中制得O2的化学方程式为_____________,若用B中方法收集氧气,证明氧气集满的方法是_________________,将燃着的蜡烛放入B中的集气瓶中,观察到的现象是_____________。
(3)C中现象是:剧烈燃烧,放出大量的热,_____________,生成黑色固体;C中反应方程式是________________。C中集气瓶中水的作用是_____________。
40. (4分)实验小组同学用下述两种装置进行空气中氧气含量的探究实验,请依据实验装置回答问题。
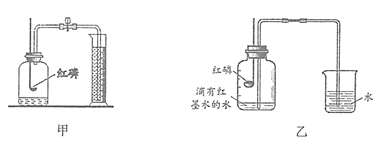
(1)实验甲中集气瓶中空气的体积为450 mL,量筒中水的体积为500 mL。实验结束后,量筒中水剩余420mL,则根据实验结果可测得空气中氧气含量约为_____________(列计算式)。
(2)乙中实验中观察到烧杯中的水变为红色,原因是__________________________。
41. (1分)用如图装置进行实验。观察到棉花团均变红,能说明氨气密度比空气小的现象是_________________。
42. (7分)根据下图所示的实验回答问题。

(1)用甲图装置研究分子的性质:甲中观察到的实验现象是_________________;该实验可证明分子具有的性质是_____________;设计冷、热水实验的目的是研究品红分子在水中的_________________与________________的关系。
(2)乙是验证质量守恒定律。其中红磷燃烧的化学方程式为_________________;充分反应并冷却后,天平仍保持平衡,从微观的角度解释其原因:_________________。
43. (2分)用下图所示的装置进行实验,验证质量守恒定德。
| 实验1 | 实验2 | ||
实验药品 | 硫酸铜溶液、铁 | 过氧化氢溶液、二氧化锰 | ||
电子秤示数 | 反应前 | m1 | m3 | |
反应后 | m2 | m4 | ||
(1)实验2中药品混合后,烧杯内可观察到的现象为_____________________。
(2)比较反应前后电子秤示数,描述正确的是_________________(填序号)。
A. m1=m2 B. m1<m2 C. m3=m4 D. m3>m4
【科学探究】
44. (6分)84消毒液(主要成分为次氯酸钠NaClO)可用于物体表面和环境消毒。用钛、石墨等作电极组装简易装置电解食盐水可制备次氯酸钠,能起到一定的应急作用。
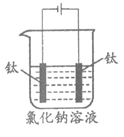
化学方程式可表示为:NaCl+H2O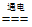 NaClO +H2↑
NaClO +H2↑
【提出问题】改变温度、氯化钠溶液浓度、电压和电极间距是否会影响该实验呢?
【查阅资料】有效氯含量可以反映次氯酸钠含量,有效氯含量越高,次氟酸钠含量越高。
【进行实验】
实验1:20℃,钛电极间距1cm,电压10V,1L氯化钠溶液,通电1小时
实验编号 | 1-1 | 1-2 | 1-3 | 1-4 | 1-5 | 1-6 |
NaCl溶液浓度 | 1% | 2% | 3% | 4% | 5% | 6% |
有效氯含量/(g/L) | 3.5 | 3.8 | 3.9 | 4 | 3.9 | 3.7 |
实验2:1L4%氯化钠溶液,通电1小时
实验编号 | 温度/℃ | 电压/V | 钛电极间距/cm | 有效氯含量/(g/L) |
2-1 | 20 | 20 | 1 | 8.4 |
2-2 | 30 | x | 1 | 8.0 |
2-3 | 40 | 20 | 1 | 7.8 |
2-4 | 20 | 20 | 0.5 | 8.2 |
2-5 | 20 | 20 | 1.5 | 8 |
【解释与结论】
(1)由实验1可知,有效氯含量随氯化钠溶液浓度变化的规律是其他条件相同时,随着氯化钠溶液浓度从1%到6%,________________。
(2)设计实验2-1、2-4、2-5的目的是____________。
(3)实验2-2中,x=_____________。
(4)能证明电压对有效氯含量有影响的实验是______________(填实验编号)。
【反思与评价】
(5)实验过程需在通风处进行并严禁烟火,原因是______________。
(6) 84消毒液对皮肤和口腔黏膜具有腐蚀性和刺激性。一般市售84消毒液有效氯含量为50g/L,根据使用需要加水稀释成0. 2g/L、0. 5g/L、1g/L。
结合本实验,下列分析正确的是____________(填字母)。
A. 使用84消毒液时建议佩戴防护口罩与手套
B. 本实验中,温度越高,有效氯含量越高
C. 实验2-1中,有效氯含量达到市售84消毒液标准
D. 本实验制备的次氯酸钠溶液需稀释后使用
参考答案
说明:每题1分,共30分
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
B | C | A | C | D | B | A | C | A | B |
11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
D | C | C | A | C | D | D | A | B | C |
21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
C | B | A | D | D | C | D | C | B | C |
说明:方程式均2分,其他未说明的均每空1分
31. (2分)
32. (9分)
(1) 21%(或1/5)
(2)①2H2O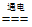 2H2↑+O2↑ ② O2 LiClO4
2H2↑+O2↑ ② O2 LiClO4
(3)吸附性
(4)①7×2+12+16×3 ②2LiOH+CO2= Li2CO3+H2O
33. (2分)
(1)C (2) AC
34. (2分)
(1)+1 (2)分解反应
35. (7分)
(1)葡萄的果皮薄等 (2) VC (3)成熟度和时间(2分)
(4)龙眼 (5)C (6) AB
36. (6分)
(1) CH4+H2O 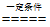 CO+3H2 (2分) (2)
CO+3H2 (2分) (2)
(3) H2 H2O、CO、CO2(2分)
37. (5分)
(1) O2 (2)化合 (3) 3NO2+H2O===2HNO3+NO (2分) (4) NO
38. (5分)
(1)+4
(2)增加反应物的接触面积,增大反应速率,使反应更充分
(3)因为反应物中含有碳元素和氧元素
(4) TiCl4+2Mg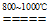 2MgCl2+Ti
2MgCl2+Ti
39. (12分)
(1) 2KMnO4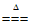 K2MnO4+MnO2+O2↑ 防止固体粉末进入导管
K2MnO4+MnO2+O2↑ 防止固体粉末进入导管
氧气不易溶于水且不与水反应
(2) 2H2O2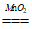 2H2O+O2↑ 将带火星的木条放在试管口,若木条复燃,则满蜡烛燃烧更旺
2H2O+O2↑ 将带火星的木条放在试管口,若木条复燃,则满蜡烛燃烧更旺
(3)火星四射 3Fe+2O2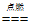 Fe3O4 防止高温物质溅落集气瓶底,引起集气瓶炸裂
Fe3O4 防止高温物质溅落集气瓶底,引起集气瓶炸裂
40. (4分)每空2分
(1) (500-420) /450
(2)红磷燃烧放热,集气瓶内温度升高,压强变大,将红墨水压入烧杯中
41. (1分)棉花团①比棉花团③先变红
42. (7分)
(1)品红在水中扩散至水变红,而且热水比冷水变红更快 分子是不断运动的 运动速率 温度
(2) 4P+5O2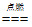 2P2O5 反应前后原子的种类和个数均不变
2P2O5 反应前后原子的种类和个数均不变
43. (2分)
(1)产生大量气泡 (2) AD
44. (6分)
(1)有效氯含量先增大后减小。
(2)探究改变钛电极间距是否影响该实验
(3) 20
(4) 1-4和2-1
(5)生成可燃性气体氢气,遇明火易爆炸
(6) AD