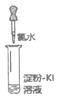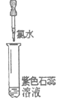本试卷有2道大题,考试时长90分钟,满分100分。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35. 5 Fe-56 Cu-64
I卷
一、选择题(25道小题,每小题2分,共50分,每小题只有1个选项符合题意)
1. 下列物质中,属于纯净物的是
A. 浓硫酸 B. 碘酒 C. 液氯 D. 84消毒液
2. 建国70周年阅兵式上,空军部队飞机拉出绚烂的”彩烟”。形成”彩烟”的原理是,吊舱中的液态彩色物质被高压N2吹出,随高温尾气喷出,冷凝后形成”彩烟”。下列有关说法正确的是
A. 彩烟是一种纯净物
B. 蒸汽凝结为雾发生了化学变化
C. 蒸汽遇冷形成的雾是一种分散系
D. 拉烟原理与焰色试验的原理相同
3. 下列有关电解质的叙述正确的是
A. 液态HCl不导电,所以HCl是非电解质
B. CO2的水溶液能够导电,所以CO2是电解质
C. 液态Cl2不导电,所以Cl2是非电解质
D. BaSO4溶于水的部分能够电离,所以BaSO4是电解质
4. 下列说法正确的是
A. 纯碱、烧碱均属于碱 B. Na2CO3·10H2O属于纯净物
C. 凡是能在水中电离出H+的化合物均属于酸 D. 盐类物质一定含有金属阳离子
5. 科学家制得一种新型分子O4。关于O4和O2的下列说法不正确的是
A. 互为同素异形体 B. 等质量的O4和O2所含原子数相同
C. 都属于单质 D. 它们的摩尔质量相同
6. 下列离子方程式书写正确的是
A. Na加到CuSO4溶液中 2Na+Cu2+= Cu+2Na+
B. 氢氧化镁与稀硫酸反应 H++OH–= H2O
C. 向硝酸银溶液中加盐酸 AgNO3+Cl–= AgCl↓+NO3–
D. 用氢氧化铝治疗胃酸(盐酸)过多 Al(OH)3+3H+= Al3++3H2O
7. 下列转化中,需要加入还原剂才能实现的是
A. Na→NaOH B. HCO3–→CO2 C. Fe3+→Fe2+ D. Cl–→Cl2
8. 钠与水反应的现象和钠的下列性质无关的是
A. 钠的熔点较低 B. 钠的密度小于水
C. 钠的硬度较小 D. 钠的还原性强
9. 水与下列物质反应时,水表现出氧化性的是
A. Cl2 B. Na C. Na2O D. Na2O2
10. 下列物质的保存方法,与其化学性质无关的是
A. 金属钠保存在煤油中 B. 浓盐酸需密闭保存
C. 新制氯水密闭存放于棕色瓶中 D. 过氧化钠需保持干燥密闭保存
11. 下列说法正确的是
A. 盐酸既有氧化性,又有还原性
B. 阳离子只有氧化性,阴离子只有还原性
C. 氧化剂在反应中被氧化,还原剂在反应中被还原
D. 在氧化还原反应中,氧化剂与还原剂不可能是同一种物质
12. 下列说法中,不正确的是
A. “物质的量”表示含有一定数目粒子的集体,是七个基本物理量之一
B. “摩尔”是物质的量的单位
C. 1 mol任何物质都约含6.02×1023个原子
D. 一个水分子的质量约为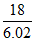 ×10-23 g
×10-23 g
13. 关于同温、同压下等体积的CO2和CO的叙述:①质量相等;②密度相等;
③所含分子个数相等;④所含碳原子个数相等,其中正确的是
A. ①②③④ B. 只有②③④ C. 只有③④ D. 只有③
14. 下列叙述正确的是
A. 常温常压下,14gN2含有的分子数约为3.01×1023
B. 64gSO2含有的氧原子数约为6.02×1023
C. 标准状况下,22.4 L H2O含有的分子数约为6.02×1023
D. 56gFe与足量Cl2反应转移的电子数为2NA
15. 下列关于Na2CO3和NaHCO3的叙述中,正确的是
A. NHCO3的俗称是苏打
B. 同浓度的两种溶液可以用石灰水鉴别
C. 相同条件下,在水中Na2CO3的溶解度小于NHCO3的溶解度
D. 向Na2CO3和NaHCO3固体中分别滴加等浓度的盐酸,后者反应更剧烈
16. 已知5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,下列说法不正确的是
A. KClO3是氧化剂 B. H2SO4既不是氧化剂也不是还原剂
C. KCl是还原剂 D. 氧化产物、还原产物的物质的量之比为1:5
17. 下列各组离子,能在溶液中大量共存的是
A. H+、Ca2+、Cl–、CO32- B. Na+、H+、SO42-、OH–
C. K+、Na+、OH–、Cl– D. Ag+、Ba2+、Cl–、SO42-
18. 已知PbO2在盐酸溶液中易生成PbCl2,且PbO2、Cl2、FeCl3、I2 的氧化性依次减弱。下列叙述中,正确的是
A. Cl2通入FeI2溶液中,可存在反应3Cl2+6FeI2= 2FeCl3+4FeI3
B. 每1molPbO2在盐酸溶液中被氧化生成PbCl2时转移电子2mol
C. FeCl3溶液能将KI溶液中的I–氧化生成I2
D. I2具有较强的氧化性,可以将PbCl2氧化成PbO2
19. 鉴别K2CO3和NaHCO3两种白色固体的下列方案中,不可行的是
A. 分别配成溶液,进行焰色试验,观察火焰的颜色
B. 分别在试管中加热,将可能产生的气体通入澄清石灰水,观察有无浑浊出现
C. 分别配成稀溶液,滴加CaCl2溶液,观察有无白色沉淀产生
D. 分别加入过量盐酸,看有无气泡产生
20. 在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A. 氯水的颜色呈黄绿色,说明氯水中含有Cl2
B. 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl–
C. 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有大量的H+
D. 新制氯水能使红色布条褪色,说明氯水中含有Cl2
21. 如下图所示,A处通入湿润的Cl2,关闭B阀时,C处干燥的红布条看不到明显现象;当打开B阀后,C处红布条逐渐褪色,则D瓶中装的是
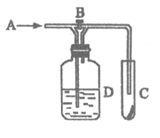
A. 稀盐酸 B. 饱和NaCl溶液
C. 浓硫酸 D. H2O
22. 某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水,有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸,有气泡产生,振荡后仍有固体存在。
该白色粉末可能为
A. NaHCO3、Mg(OH) 2 B. AgCl、NaHCO3
C. Na2CO3、 BaCO3 D. Na2CO3、CuSO4
23. 已知aRO4x-+bH++cCl–=dR2++5Cl2↑+8H2O,则RO4x-中R的化合价为
A. +4 B. +5 C. +6 D. +7
24. K2FeO4是优良的饮用水处理剂,一种制备方法是将Fe2O3、KNO3、KOH混合共熔,反应为Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O。下列关于该反应的说法不正确的是
A. 铁元素被氧化,氮元素被还原 B. 氧化性:KNO3 >K2FeO4
C. 每生成1mol K2FeO4,转移6mole– D. K2FeO4具有杀菌作用
25. CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法不正确的是
A. Cu2+是H2O2分解反应的催化剂
B. H2O2既表现氧化性又表现还原性
C. Cu2+将H2O2还原为O2
D. 发生了反应Cu2O+H2O2+4H+=2Cu2++3H2O
II卷
二、非选择题(共9道小题,共50分)
1. (4分)有四种物质:①氧化铁 ②盐酸 ③碳酸氢钠 ④氢氧化钠
(1)写出其中盐的电离方程式_______________。
(2)上述物质中有一种与其它三种物质均能反应,此物质是___________(填序号)。
(3)写出③④两种溶液反应的离子方程式___________。
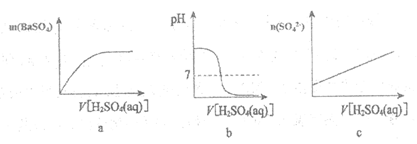
2. (4分)如图所示:向饱和Ba(OH)2溶液中逐滴加入稀硫酸,不断搅拌至过量。
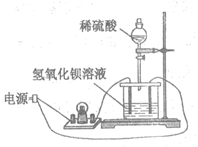
(1)主要的实验现象:产生白色沉淀,灯泡_______________。
(2)烧杯中反应的离子方程式:______________________。
(3)下列图示能正确表示实验过程的是___________(填字母)。
3. (6分)某课外实验小组从煤油中取出一块钠,用滤纸吸干其表面的煤油,用刀切下数块,分别进行实验研究。
(1)钠块切面表面迅速变暗,反应的化学方程式为___________。
(2)将其中一块钠放入坩埚中加热,反应现象为:钠熔化并燃烧___________。
(3)将一小块钠放入燃烧匙中,加热,迅速伸入盛有氯气的集气瓶中,反应的化学方程式为_______________。
(4)钠在空气中的燃烧产物可用于呼吸面具或潜水艇中氧气的来源,涉及的主要反应的化学方程式为①___________,②____________。若15.6g Na2O2参加反应,则最多可制得标准状况下氧气的体积为_______________L。
4. (4分)用Cl2和石灰乳可以制备漂粉精,漂粉精可于游泳池的消毒。
(1)写出制备漂粉精的化学方程式______________。
(2)漂粉精真正起消毒作用的物质是HClO。漂粉精在水中释放HClO的途径如下:
途径1:Ca(ClO)2 +2H2O  Ca(OH)2+2HClO
Ca(OH)2+2HClO
途径2:Ca(ClO)2+H2O+CO2=___________+___________(把反应补充完整)
(3)游泳池水的酸碱性对漂粉精的消毒效果影响明显。
①池水碱性过强,杀毒作用会___________(填”增强”或”减弱”)。
②池水酸性过强,会刺激眼睛和皮肤。通常加入Na2CO3、NaHCO3以降低酸性,
起到降低酸性作用的离子分别是_______________(填离子符号)。
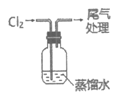
5. (7分)实验室用下图装置制备并收集干燥纯净的Cl2。
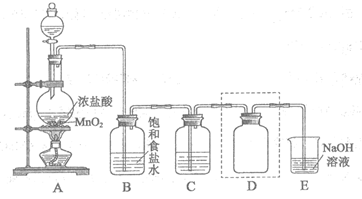
(1)装置A中反应的离子方程式是___________。
(2)装置B的作用是___________。
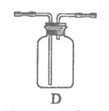
(3)装置C中盛放的物质是___________。
(4)装置D用于收集Cl2,请将图中装置D的导气管补充完整。
(5)装置E用于吸收尾气,E中反应的离子方程式是___________。
6. (6分)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可以减少该有害物质向环境排放。例如:
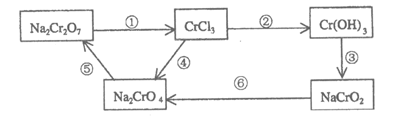
(1)完成方程式,回答相关问题。用单线桥标出反应①的电子转移的方向和数目。
反应①为:_____Na2Cr2O7+____HCl=___NaCl+____CrCl3+____Cl2↑+ ____H2O
反应⑥为:_____ClO3–+ _____CrO2–+ _____ = =____Cl–+____CrO42-+____H2O
= =____Cl–+____CrO42-+____H2O
反应⑥中还原剂为____________,还原产物为____________。
(2)在上述转化中,需用氧化剂的步骤是_____________(填编号)。
7. (4分)KMnO4在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
I. 将软锰矿(主要成分MnO2)粉碎后,与KOH固体混合,通入空气充分焙烧,生成暗绿色(K2MnO4)熔融态物质。
Ⅱ. 冷却,将固体研细,用KOH溶液浸取,过滤,得暗绿色溶液。
III. 向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体MnO2。
IV. 过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
(1)I中,粉碎软锰矿的目的是___________。
(2)I中,生成K2MnO4的化学方程式是_______________。
(3) II中,浸取时用KOH溶液的原因是___________。
(4)Ⅲ中,CO2和K2MnO4在溶液中反应的化学方程式是______________________。
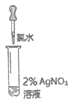
8. (9分)化学小组同学为探究新制氯水的成分及性质进行了如下实验:
【资料】I2遇到淀粉溶液变蓝,常用于检验碘的存在。
实验① | 实验② | 实验③ | 实验④ | 实验⑤ | |
实验操作 (试管中溶液均为1mL,均滴入5滴氯水) |
|
|
|
|
|
实验现象 | 蒸馏水由无色逐渐变为浅黄绿色 | 溶液变蓝 | 石蕊溶液先变红,后褪色 | 产生白色沉淀 | 产生大量无色气泡 |
(1)实验②的现象可推断氧化性:Cl2___________I2(填”>”或”<“)。
(2)证明氯水中含有Cl–的是实验_______________(填序号),用离子方程式表示该实验中涉及的反应____________、_______________。
(3)实验③中溶液变红是由于溶液中含有_______________(填微粒符号,下同);使溶液褪色的微粒是_______________。
(4)同学们根据”H2O2在催化剂作用下可发生分解”的性质,认为实验⑤中现象不能说明氧化性Cl2 >H2O2。为证实Cl2将H2O2氧化,可继续补充实验:___________(填操作、现象)。
(5)同学们发现久置的氯水会失去漂白性,溶液由黄绿色变为无色。为探究氯水失效的原因,进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如下曲线。
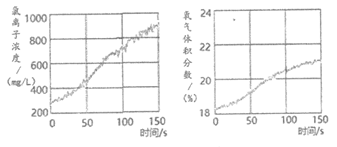
解释上两图中曲线变化的原因_______________。若在上述整个实验过程中测定溶液的pH;pH的变化是_______________。
9. (6分)为了探究过氧化钠的强氧化性,某小组设计了如图所示的实验装置。
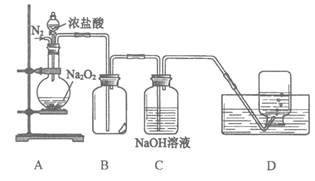
实验步骤及现象如下:
I. 检查装置气密性后,装入药品并连接仪器。
Ⅱ. 缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,A中剧烈反应,有黄绿色气体产生。
Ⅲ,待产生连续气泡后,将装置D中的导管末端伸入集气瓶中,收集到无色气体。
IV. 反应一段时间后,关闭分液漏斗的活塞,再通一段时间N2,直至装置中气体变为无色。
回答下列问题:
(1)装置D中收集的无色气体能使带火星的木条复燃,据此推断该气体是_______________,解释产生该气体的原因是(用化学方程式表示)_______________。
(2)装置B中湿润的淀粉碘化钾试纸变蓝(生成I2)。甲同学认为是生成的氯气氧化了碘化钾;乙同学认为使试纸变蓝的原因也可能是___________。
(3)资料显示,Na2O2与干燥的HCl能发生化学反应生成Cl2,该反应的化学方程式为:______________________。
参考答案
一、选择题(每小题2分,共50分)
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
C | C | D | B | D | D | C | C | B | B | A | C | C |
14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
A | D | D | C | C | D | D | C | C | D | C | C |
二、非选择题(共50分)
1. (4分)
(1) NaHCO3= Na++HCO3一 (2)② (3) OH–+HCO3–=CO32-+H2O
2. (4分)
(1)由亮变暗直至熄灭,后来又逐渐变亮
(2) 2OH–+Ba2++2H++SO42-=BaSO4↓+2H2O
(3)ab
3. (6分)
(1)4Na+O2=2Na2O
(2)黄色火焰,有淡黄色固体生成
(3) 2Na+Cl2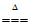 2NaCl
2NaCl
(4) ①2Na2O2+2CO2=2Na2CO3+O2, ②2Na2O2+2H2O=4NaOH+O2↑ 2.24L
4. (4分)
(1) 2Cl2 +2Ca(OH)2= Ca(ClO)2+ CaCl2+2H2O
(2) Ca(ClO)2+H2O+CO2 =CaCO3+2HClO
(3)①减弱 ②CO32-、HCO3–
5. (7分)
(1) MnO2+4H++2Cl–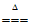 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)除去Cl2中混有的HCl
(3)浓硫酸
(4)
(5) Cl2+2OH–=Cl–+ClO–+H2O
6. (6分)
(1)反应①为: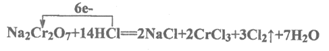
反应⑥为:ClO3–+2CrO2–+2OH–=Cl–+2CrO42-+H2O
还原剂:CrO2–。 还原产物:Cl–
(2)④⑥
7. (4分)
(1)增大反应物接触面积,加快反应速率
(2) 2MnO2+4KOH+O2 2K2MnO4+2H2O
2K2MnO4+2H2O
(3)保持溶液呈强碱性,防止K2MnO4发生歧化反应
(4)3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
8. (9分)
(1)> (2)④ Cl2+H2O=H++Cl–+HClO、Cl–+Ag+=AgCl↓
(3)H+(或HCl) HClO
(4)反应后向溶液中加入1 mL 2%AgNO3溶液,产生的沉淀量明显大于实验④
(5)由于2HClO 2HCl+O2↑,使O2体积分数增加;Cl2与水不断反应和HClO分解生成的HCl使溶液中c(Cl–)增大
2HCl+O2↑,使O2体积分数增加;Cl2与水不断反应和HClO分解生成的HCl使溶液中c(Cl–)增大
溶液的pH随时间增长逐渐减小(最终不变)
9. (6分)
(1)O2; 2Na2O2+4HCl=4NaCl+2H2O+O2
(2)O2也具有氧化性,也可能将I–氧化为I2
(3)Na2O2+4HCl=Cl2+2NaCl+2H2O