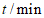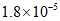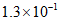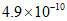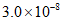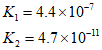本试卷有2道大题,考试时长90分钟,满分100分。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Cl—35.5 Na—23 Mg—24 Fe—56 Cu—64 Zn—65 Ba—137
一、选择题(共25道小题,共50分,每小题只有1个选项符合题意)
1. 下列物质属于强电解质的是
A. SO3 B. Fe(OH)3 C. 盐酸 D. NaOH
2. 下列热化学方程式正确的是
A. C2H5OH+3O2=2CO2+3H2O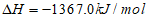
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)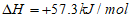
C. S(s)+O2(g)=SO2(g)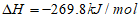
D. 2NO(g)+O2(g)=2NO2(g)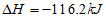
3. 某一温度下,可判断溶液为中性的依据是
A. c(H+)=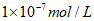 B. c(H+)=c(OH-)
B. c(H+)=c(OH-)
C. pH=7 D. 加入酚酞后溶液呈无色
4. 在3A(g)+2B(g) C(g)+4D(g)反应中,表示该反应速率最快的是
C(g)+4D(g)反应中,表示该反应速率最快的是
A. v(A)=0.9mol/(L·s) B. v(B)=0.3mol/(L·s)
C. v(C)=0.4mol/(L·s) D. v(D)=0.8mol/(L·s)
5. N2(g)+3H2(g)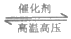 2NH3(g)
2NH3(g) 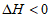 。当反应达到平衡时,下列措施能提高N2转化率的是
。当反应达到平衡时,下列措施能提高N2转化率的是
①降温 ②恒压通入惰性气体 ③增加N2的浓度 ④加压
A. ①④ B. ①② C. ②③ D. ③④
6. 室温下,关于1.0mL 0.1mol/L氨水,下列判断正确的是
A. 溶液的pH等于13
B. 加入少量NH4Cl固体,c(OH-)不变
C. c(OH-)=c(NH4+)+c(H+)
D. 与1.0mL 0.1mol/L盐酸混合后,溶液呈中性
7. 用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是
2Cl2(g)+2H2O(g)。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是
A. 气体的质量不再改变
B. 氯化氢的转化率不再改变
C. 断开4mol H-Cl键的同时生成4mol H-O键
D. n(HCl):n(O2):n(Cl2):n(H2O)=4:1:2:2
8. 下列事实中,能用勒夏特列原理解释的是
A. 火电厂中燃烧煤粉以提高燃煤效率
B. 工业合成氨时采用较高的温度(400℃~500℃)
C. 密闭的注射器中装有NO2和N2O4的混合气体,向外拉活塞,最终气体颜色变浅
D. 实验室用排饱和食盐水法收集氯气
9. 下列关于有效碰撞理论与影响速率因素之间关系正确的是
A. 增大反应物浓度,可以提高活化分子百分数,从而提高反应速率
B. 对于气体反应来说,通过压缩体积增大压强,可以提高单位体积内活化分子数,从而提高反应速率
C. 温度升高,分子动能增加,反应所需活化能减少,反应速率增大
D. 选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大。
10. 已知反应A2(g)+3B2(g) 2AB3(g)
2AB3(g) 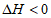 ,下列说法正确的是
,下列说法正确的是
A. 升高温度,正、逆反应速率都加快,且正反应速率加快更明显
B. 升高温度能缩短达到平衡所需的时间且提高A2的转化率
C. 达到平衡后,同时升高温度和增大压强,n(AB3)有可能不变
D. 达到平衡后,降低温度或减小压强都有利于该平衡向正反应方向移动
11. 为消除NO对环境的污染,可利用NH3在一定条件下与NO反应生成无污染的气体。
已知:
①N2(g)+O2(g) 2NO(g)
2NO(g)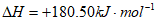
②4NH3(g)+5O2(g)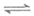 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)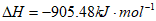
则反应4NH3(g)+6NO(g)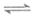 5N2(g)+6H2O(g)的
5N2(g)+6H2O(g)的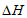 为
为
A. 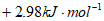 B. -2.98
B. -2.98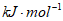
C. +1807.98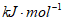 D. -1807.98
D. -1807.98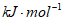
12. 由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法不正确的是
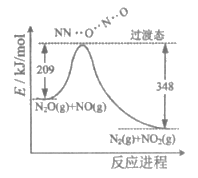
A. 反应生成1molN2时转移4mol e-
B. 反应物能量之和大于生成物能量之和
C. N2O(g)+NO(g)=N2(g)+NO2(g)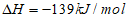
D. 反应过程中断键吸收能量之和小于成键释放能量之和
13. 以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
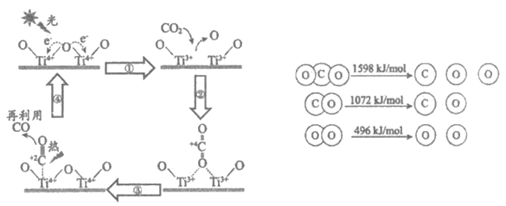
下列说法正确的是
A. 过程①中钛氧键断裂会释放能量
B. 该反应中,光能和热能转化为化学能
C. 使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D. CO2分解反应的热化学方程式为2CO2(g)=2CO(g)+O2(g) 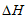 =+30kJ/mol
=+30kJ/mol
14. 已知:
①C2H6(g) C2H4(g)+H2(g)
C2H4(g)+H2(g)
②C2H6(g)+7/2O2=2CO2(g)+3H2O(1) 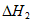 =-1559.8kJ·mol-1
=-1559.8kJ·mol-1
③C2H4(g)+3O2(g)=2CO2(g)+2H2O(1) 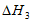 =-1411.0kJ·mol-1
=-1411.0kJ·mol-1
下列叙述正确的是
A. 升温或加压均能提高①中乙烷的转化率
B. ①中断键吸收的能量少于成键放出的能量
C. 用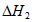 和
和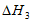 可计算出
可计算出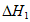
D. 推测1mol C2H2(g)完全燃烧放出的热量小于1411.0kJ
15. 一定温度下,水溶液中H+和OH-的浓度变化曲线如图所示,下列说法正确的是
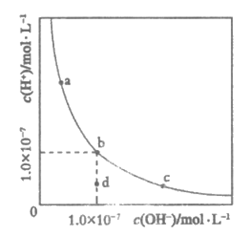
A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为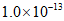
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
16. 一定温度下,反应I2(g)+H2(g)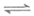 2HI(g)在密闭容器中达到平衡时,测得c(I2)=0.11mmol·L-1、c(H2)=0.11mmol·L-1、c(HI)=0.78mmol·L-1。相同温度下,按下列4组初始浓度进行实验,反应逆向进行的是
2HI(g)在密闭容器中达到平衡时,测得c(I2)=0.11mmol·L-1、c(H2)=0.11mmol·L-1、c(HI)=0.78mmol·L-1。相同温度下,按下列4组初始浓度进行实验,反应逆向进行的是
A | B | C | D | |
c(I2)/mmol·L-1 | 1.00 | 0.22 | 0.44 | 0.11 |
c(H2)/mmol·L-1 | 1.00 | 0.22 | 0.44 | 0.44 |
c(HI)/mmol·L-1 | 1.00 | 1.56 | 4.00 | 1.56 |
17. 室温下,下列有关两种溶液的说法不正确的是
序号 | ① | ② |
pH | 12 | 12 |
溶液 | 氨水 | 氢氧化钠溶液 |
A. ①②两溶液中c(OH-)相等
B. ①溶液的物质的量浓度为0.01mol·L-1
C. ①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D. 等体积的①②两溶液分别与0.01mol·L-1的盐酸完全中和,消耗盐酸体积①>②
18. 在一定条件下,利用CO2合成CH3OH的反应如下:
①CO2(g)+3H2(g)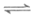 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 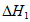 ,
,
研究发现,反应过程中会有副反应:
②CO2(g)+H2(g)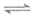 CO(g)+H2O(g)
CO(g)+H2O(g) 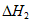 。
。
温度对CH3OH、CO的产率影响如图所示。下列说法中,不正确的是
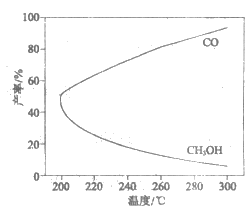
A. 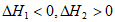
B. 增大压强有利于提高CH3OH的产率
C. 生产过程中,升温加快①的速率,减慢②的速率
D. 合成CH3OH反应的平衡常数表达式是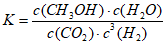
19. 用O2将HCl转化为Cl2,反应方程式为:4HCl(g)+O2(g)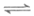 2H2O(g)+2Cl2(g)
2H2O(g)+2Cl2(g)  。一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是
。一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是
| 0 | 2 | 4 | 6 |
c(Cl2)/10-3mol·L-1 | 0 | 1.8 | 3.7 | 5.4 |
A. 0~2min的反应速率小于4~6 min的反应速率
B. 2~6 min用O2表示的反应速率为0.9 mol/(L·min)
mol/(L·min)
C. 增大压强可以提高HCl转化率
D. 平衡常数K(200℃)<K(400℃)
20. 已知:2NO(g)+O2(g) 2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图),下列说法不正确的是
2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图),下列说法不正确的是
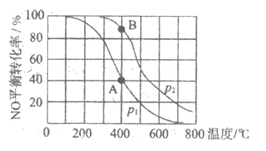
A. 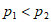
B. 该反应的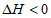
C. A、B两点的平衡常数: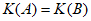
D. 其它条件不变,通入一定量的NO,可使A点到B点
21. 向10.00mL0.01mol·L-1某一元酸HA溶液中逐滴加入0.01mol·L-1NaOH溶液,溶液pH变化曲线如图所示。下列说法不正确的是
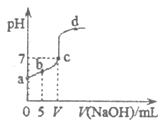
A. HA是弱酸
B. b点表示的溶液中:2c(Na+)=c(A-)+c(HA)
C. C点时:V=10.00mL
D. b、c、d点表示的溶液中:c(Na+)+c(H+)=c(A-)+c(OH-)
22. 常温下2mL 1mol/L NaHCO3溶液,pH约为8,向其中滴加几滴饱和CaCl2溶液,有白色沉淀和无色气体生成,下列说法中,不正确的是
A. NaHCO3溶液中,HCO3-水解程度大于其电离程度
B. NaHCO3溶液中,c(Na+)>c(HCO3)>c(OH-)>c(H+)
C. 最终所得的混合溶液中,c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D. 滴加饱和CaCl2溶液促进了HCO3-的电离
23. 室温下,将0.05mol Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质。有关结论正确的是
加入的物质 | 结论 | |
A | 50mL 1mol/L H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
B | 0.05mol CaO | 溶液中,c(OH-)/c(HCO3-)增大 |
C | 50mL H2O | 溶液中的c(H+)·c(OH-)减小 |
D | 0.1mol NaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
24. 实验:
①0.005mol·L-1 FeCl3溶液和0.015mol·L-1 KSCN溶液各1mL混合得到红色溶液a,均分溶液a置于b、c两支试管中;
②向b中滴加3滴饱和FeCl3溶液,溶液颜色加深;
③再向上述b溶液中滴加3滴1mol·L-1 NaOH溶液,溶液颜色变浅且出现浑浊;
④向c中逐渐滴加1mol·L-1KSCN溶液2mL,溶液颜色先变深后变浅。
下列分析不正确的是
A. 实验②中增大Fe3+浓度使平衡Fe3++3SCN- Fe(SCN)3正向移动
Fe(SCN)3正向移动
B. 实验③中发生反应:Fe3++3OH-=Fe(OH)3↓
C. 实验③和④中溶液颜色变浅的原因相同
D. 实验②、③、④均可说明浓度改变对平衡移动的影响
25. 实验测得0.5mol·L-1 CH3COONa溶液、0.5mol·L-1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是
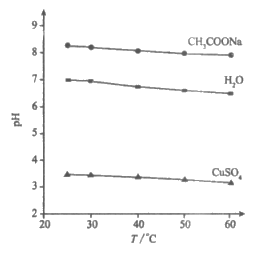
A. 随温度升高,纯水中c(H+)>c(OH-)
B. 随温度升高,CH3COONa溶液的c(OH-)减小
C. 随温度升高,CuSO4溶液的pH变化是KW改变与水解平衡移动共同作用的结果
D. 随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu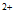 水解平衡移动方向不同
水解平衡移动方向不同
二、非选择题(共6道小题,共50分)
26. (4分)优化反应条件是研究化学反应的重要方向。
以硫代硫酸钠与硫酸的反应Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O为例,探究外界条件对化学反应速率的影响,实验方案如下表所示。
实验 序号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | 温度/℃ | ||
浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | 体积/mL | ||
Ⅰ | 0.1 | 1.5 | 0.1 | 1.5 | 10 | 20 |
Ⅱ | 0.1 | 2.5 | 0.1 | 1.5 | 9 | a |
Ⅲ | 0.1 | b | 0.1 | 1.5 | 9 | 30 |
表中,a为__________,b为__________。
上述三个实验中的反应速率最快的应该是实验__________(用Ⅰ、Ⅱ、Ⅲ作答)。
支持这一结论的实验现象为____________________。
27. (5分)常温下,有下列四种溶液:
①HCl ②H2CO3 ③NaOH ④NH3·H2O ⑤NaHSO3 ⑥FeCl3
(1)②是二元弱酸,它的电离方程式是:____________________。
(2)⑤溶液呈电中性,请写出⑤溶液中电荷守恒表达式:____________________。
(3)等体积、等浓度的①溶液、④溶液反应,所得溶液中离子浓度大小顺序是____________________
(4)25℃时,99mL 0.1mol/L的①溶液与101mL 0.1mol/L的③溶液混合后,所得溶液pH=__________。(忽略混合过程中的体积变化)
(5)⑥可用作净水剂,请用化学用语解释原因:____________________。
28. (7分)合成氨对人类生存具有重大意义,反应为:
N2(g)+3H2(g)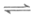 2NH3(g)
2NH3(g)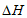
(1)科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如下图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
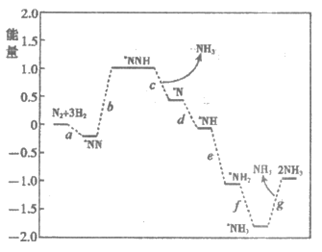
①NH3的电子式是____________________。
②写出步骤c的化学方程式____________________。
③由图像可知合成氨反应的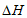 _______0(填”>”、”<“或”=”)。
_______0(填”>”、”<“或”=”)。
(2)传统合成氨工艺是将N2和H2在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入5mol N2、15mol H2,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如下图所示。
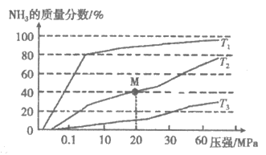
①温度T1、T2、T3大小关系是__________。
②M点的平衡常数K=__________(用分数表示)。
29. (8分)研究弱电解质的电离,有重要的实际意义。
Ⅰ. 醋酸是一种常见的有机酸
(1)醋酸的电离方程式为____________________。
(2)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是__________。
A. c(CH3COO-) B. c(H+)
C. c(OH-) D. CH3COOH电离平衡常数
(3)将0.1mol·L-1CH3COOH溶液加水稀释,c(CH3COO-)/c(CH3COOH)的比值将____________(填”变大”、”不变”或”变小”)。
(4)下列事实不能说明CH3COOH是弱电解质的是__________(填字母)。
A. 相同温度下,浓度均为1mol·L-1的盐酸和醋酸的导电性对比:盐酸>醋酸
B. 1mol·L-1 CH3COONa溶液能使紫色石蕊试液变蓝
C. 25℃时,1mol·L-1CH3COOH溶液的pH约为2
D. 10mL 1mol·L-1的CH3COOH溶液恰好与10mL 1mol·L-1NaOH溶液完全反应
Ⅱ. 对比酸性的相对强弱
(5)某些弱酸在25℃时的电离常数如下:
化学式 | CH3COOH | HSCN | HCN | HClO | H2CO3 |
电离常数 |
|
|
|
|
|
①下列反应可以发生的是__________(填字母)。
A. CH3COOH+Na2CO3=NaHCO3+CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
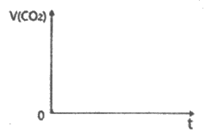
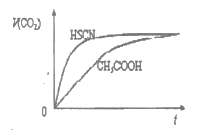
②将20mL 1mol·L-1CH3COOH溶液和20mL 1mol·L-1 HSCN溶液分别与20mL 1mol·L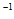 NaHCO3溶液混合,画出产生的CO2气体体积(V)随时间(t)的变化关系图,并注明对应酸的化学式。
NaHCO3溶液混合,画出产生的CO2气体体积(V)随时间(t)的变化关系图,并注明对应酸的化学式。
30. (12分)亚硫酸盐是一种常见的食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组同学设计了如下实验方案。
Ⅰ. 称取样品Wg;
Ⅱ. 向样品中加入足量稀硫酸;
Ⅲ. 将Ⅱ中产生的SO2用足量H2O2溶液吸收;
Ⅳ. 将Ⅲ所得硫酸溶液用氢氧化钠标准液滴定;
Ⅴ. 数据处理。
(1)Na2SO3是一种食品添加剂。写出Na2SO3与稀硫酸反应的离子方程式:____________________。
(2)步骤Ⅲ中H2O2的作用是____________________。
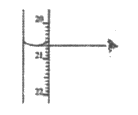
(3)步骤Ⅳ中可选用的指示剂为__________。下图显示滴定终点时,滴定管(量程为25mL)读数为__________。
(4)步骤Ⅳ中消耗0.010mol/L NaOH溶液VmL,则1kg样品中含SO2的质量是__________g(用含W、V的代数式表示)。
(5)步骤Ⅳ中的下列操作会造成该实验亚硫酸盐含量测定结果偏低的有__________
a. 量取一定体积待测硫酸溶液前,酸式滴定管未用待测硫酸溶液润洗
b. 装入氢氧化钠标准液前,碱式滴定管未用氢氧化钠标准液润洗
c. 锥形瓶内用水冲洗后未干燥
d. 在滴定过程中发现局部溶液发生色变就立即停止滴定
e. 滴定终点读数是俯视读数
31. (14分)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2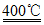 2Cl2+2H2O
2Cl2+2H2O
(1)已知:i. 反应A中,4mol HCl被氧化,放出115.6kJ的热量。
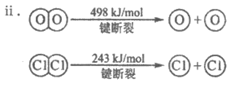
①反应A的热化学方程式是____________________。
②反应A中反应物所具有的焓__________生成物所具有的焓(填”大于”或”小于”)。
③断开1mol H—O键与断开1mol H—Cl键所需能量相差约为__________kJ,H2O中H—O键比HCl中H—Cl键(填”强”或”弱”)__________。
(2)对于反应A,下图是在4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
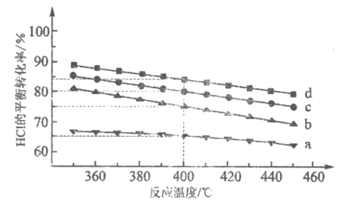
①曲线b对应的投料比是__________。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是__________。
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是__________。
【试题答案】
一、选择题(共50分)
1-5 DCBCA 6-10 CBDBC 11-15 DABDC 16-20 CBCCD 21-25 CCBCC
二、非选择题(共50分)
26. (4分)
20 2.5 Ⅲ 实验Ⅲ中出现浑浊所需时间最短
27. (5分)
(1)H2CO3 HCO3-+H+
HCO3-+H+
(2)c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-)
(3)c(Cl-)>c(NH4+)>c(H+)>c(OH-)
(4)11
(5)Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
28. (7分)
(1)①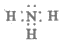
②*NNH+H2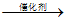 *N+NH3
*N+NH3
③<
(2)①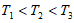 (2分)
(2分)
②16/2187 (2分)
29. (8分)
(1)CH3COOH CH3COO-+H+
CH3COO-+H+
(2)B
(3)变大
(4)D
(5)①AB (2分) ②(2分)
30. (12分)
(1)SO32-+2H+=SO2↑+2H2O
(2)将SO2氧化为硫酸
(3)酚酞或甲基橙 20.60mL
(4)8V/25W
(5)a d e
31. (14分)
(1)①4HCl(g)+O2(g)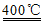 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g) 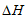 =-115.6kJ·
=-115.6kJ·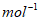 ;
;
②大于
③32 强
(2)①4:1
②投料比越高,对应的反应温度越低
③30.8%