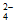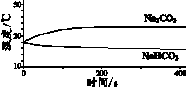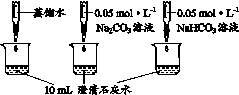本试卷共分为两个部分。第一部分为选择题,25个小题(共50分);第二部分为非选择题,9个小题(共50分)。
可能用到的相对原子质量:H 1 He 4 C 12 N 14 O 16 Na 23 Cl 35.5 As 75
第一部分 选择题(共50分)
在下列各题的4个选项中,只有1个选项符合题意。(每小题2分,共50分)
1. 在庆祝中华人民共和国成立70周年活动中用到多种材料。下列所示材料中,其主要成分属于合成高分子材料的是

A. 花坛钢架——铁合金
B. 飞机外壳——铝合金
C. 飞机轮胎——合成橡胶
D. 飞机燃料——航空汽油
2. 下列物质中,不属于电解质的是
A. Na2SO4 B. KOH
C. HNO3 D. Cu
3. 下列金属中,通常用电解法冶炼的是
A. Na B. Fe C. Hg D. Ag
4. 当光束通过下列分散系时,能观察到丁达尔效应的是
A. NaCl溶液 B. 酒精溶液 C. CuSO4溶液 D. Fe(OH)3胶体
5. 下列分子中,空间构型为正四面体的是
A. CH2 = CH2 B. CH4 C. C2H5OH D. CH3COOH
6. 下列元素的原子半径最大的是
A. F B. Cl C. Br D. I
7. 下列物质中,含离子键的是
A. H2O B. CO2 C. MgCl2 D. N2
8. 下列关于物质分类的叙述中,不正确的是
A. H2SO4属于酸 B. 液氯属于纯净物
C. NO属于氧化物 D. 碳酸钠属于碱
9. 下列关于化学反应与能量的说法中,不正确的是
A. Mg与盐酸的反应属于放热反应
B. Ba(OH)2·8H2O与NH4Cl的反应属于放热反应
C. 能量变化是化学反应的基本特征之一
D. 反应物的总能量低于生成物的总能量,反应时从环境吸收能量
10. 下列物质中,既含有氯分子,又含有氯离子的是
A. 液氯 B. 氯水 C. 盐酸 D. 氯酸钾
11. 碳在自然界的循环过程如下图所示。下列说法中,不正确的是

A. 氧元素未参与该循环过程
B. 绿色植物的光合作用可吸收CO2
C. 控制化石燃料的使用可减少碳排放
D. 动植物遗体被微生物分解可产生CO2
12. 下列关于SO2性质的说法中,不正确的是
A. SO2有毒,不能用作食品添加剂 B. 能使品红溶液褪色
C. 能与NaOH溶液反应 D. 能使酸性KMnO4溶液褪色
13. 我国科学家利用如下反应实现了低温制氢。
CO(g) + H2O(g) CO2(g)+ H2(g)
CO2(g)+ H2(g)
一定温度下,在密闭容器中,当CO、H2O、CO2、H2的浓度不再变化时,下列说法正确的是
A. CO和H2O全部转化为CO2和H2
B. 正、逆反应速率相等且等于零
C. 该反应已达化学平衡状态
D. CO、H2O、CO2、H2的浓度一定相等
14. 变量控制是科学研究的重要方法。相同质量的碳酸钙与足量1 mol·L-1盐酸分别在下列条件下发生反应,化学反应速率最大的是
选项 | 碳酸钙的状态 | 实验温度/℃ |
A | 块状 | 10 |
B | 块状 | 30 |
C | 粉末 | 10 |
D | 粉末 | 30 |
15. 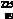 Ac(Ac的中文名”锕”)是一种医用放射性同位素,在治疗癌症方面有重大作用。下列关于
Ac(Ac的中文名”锕”)是一种医用放射性同位素,在治疗癌症方面有重大作用。下列关于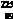 Ac的说法中,不正确的是
Ac的说法中,不正确的是
A. 质子数为225 B. 中子数为136
C. 核外电子数为89 D. 质子数与中子数之和为225
16. 下列关于乙醇的说法中,不正确的是
A. 官能团为羟基—OH B. 能与NaOH溶液反应
C. 能与Na反应 D. 能与CH3COOH反应
17. 下列反应中,属于取代反应的是
A. 甲烷燃烧生成二氧化碳和水
B. 乙烯与溴反应生成1,2-二溴乙烷
C. 乙醇与氧气在铜催化下反应生成乙醛和水
D. 甲烷与氯气反应生成一氯甲烷和氯化氢
18. 下列物质的电子式书写正确的是
A. 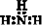 B.
B. 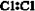 C.
C. 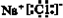 D.
D.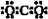
19. 某元素的原子结构示意图为  ,下列关于该元素的说法中,不正确的是
,下列关于该元素的说法中,不正确的是
A. 元素符号是S
B. 属于短周期元素
C. 非金属性比氧的强
D. 最高正化合价是+6价
20. 下列行为不符合实验安全要求的是
A. 在通风橱内制备有毒气体
B. 稀释浓硫酸时,将水注入浓硫酸中
C. 点燃氢气前,先进行验纯操作
D. 熄灭少量燃着的金属钠,用干燥沙土覆盖
21. 红糖具有益气补血、健脾暖胃等作用。下列由甘蔗制作红糖的主要步骤中,属于过滤操作的是
A. 削蔗去杂 | B. 石辘碎蔗 | C. 渣汁分离 | D. 热锅熬糖 |
|
|
|
|
22. 下列说法中,不正确的是
A. Cl2的摩尔质量是71 g / mol
B. 1 mol NH3中含有的分子数约为6.02×1023
C. 1 L 1 mol·L-1 Na2CO3溶液中含有2 mol Na+
D. 常温常压下,22.4 L CH4的物质的量为1 mol
23. 下列反应的离子方程式书写不正确的是
A. 碳酸钠溶液与足量盐酸反应:CO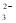 + 2H+ = CO2↑+ H2O
+ 2H+ = CO2↑+ H2O
B. 钠与水反应:Na + H2O = Na+ + OH- + H2↑
C. 氢氧化钡溶液与稀硫酸反应:Ba2+ +2OH– +2H++ SO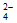 = BaSO4↓+ 2H2O
= BaSO4↓+ 2H2O
D. 铜与稀硝酸反应:3Cu + 8H+ + 2NO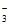 = 3Cu2+ + 2NO↑+ 4H2O
= 3Cu2+ + 2NO↑+ 4H2O
24. 硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如下图所示(CuS不溶于水)。下列说法中,不正确的是
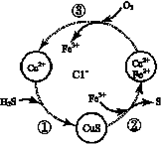
A. 过程①中,生成CuS的反应为H2S + Cu2+= CuS↓+ 2H+
B. 过程②中,Fe3+作氧化剂
C. 过程③中,各元素化合价均未改变
D. 回收S的总反应为2H2S + O2= 2H2O + 2S↓
25. 下列”实验结论”与”实验操作及现象”不相符的一组是
选项 | 实验操作及现象 | 实验结论 |
A | 向蔗糖中滴加浓硫酸,蔗糖变黑 | 浓硫酸有吸水性 |
B | 向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体 | 该溶液中一定含有NH |
C | 向某盐溶液中滴加KSCN溶液,溶液变为红色 | 该溶液中含有Fe3+ |
D | 向某溶液中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,有白色沉淀产生 | 该溶液中一定含有SO |
第二部分 非选择题(共50分)
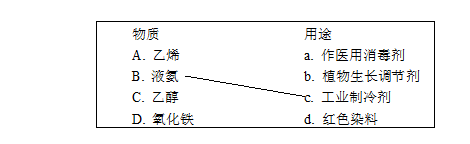
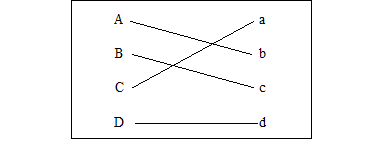
1. (3分)补齐物质及其用途的连线。
2. (4分)选择完成下列实验的装置。
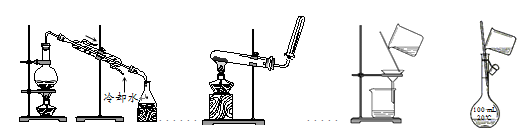
① ② ③ ④
(1)除去粗盐水中的泥沙用____(填序号,下同)。
(2)配制100 mL 0.1 mol·L-1NaCl溶液,选用______。
(3)自来水制备蒸馏水用____。
(4)加热NH4Cl和Ca(OH)2固体混合物制取NH3,用____。
3.(3分)铝热法是铝与某些金属氧化物反应获得高熔点金属单质的方法。工业上可用于制造无碳或低碳铁合金。铝粉和赤铁矿发生铝热反应的化学方程式为:
Fe2O3 + 2Al  2Fe + Al2O3
2Fe + Al2O3
上述反应中,作为氧化剂的物质是_____,若反应中消耗了2 mol Al,生成Fe的物质的量为_____mol,转移电子的物质的量为______mol。
4.(4分)化学电池的发明,是贮能和供能技术的巨大进步。
(1)下图所示装置中,Cu片是____(填”正极”或”负极”)。
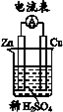
(2)图中所示装置可将____(写化学方程式)反应释放的能量直接转变为电能;能证明产生电能的实验现象是 ______。
(3)2019年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如下。
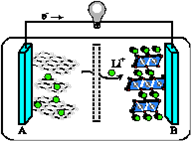
下列说法正确的是____(填序号)。
① A为电池的负极
② 该装置实现了电能转化为化学能
③ 电池工作时,电池内部的锂离子定向移动
5. (4分)某学习小组用下图装置研究Cl2的性质。
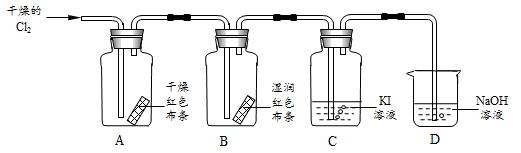
(1)观察到B中的现象是____。
(2)C中反应后的溶液遇淀粉变蓝,说明Cl2与KI溶液反应生成的物质有____。
(3)D中NaOH溶液的作用是____,离子方程式______。
(4)A、B中现象不同,结合化学方程式表示其原因是____。
6.(8分)阅读短文,回答问题。
平昌冬奥会闭幕式上,”2022,相约北京”文艺表演蕴含了丰富的中国文化,展现了新时代中国形象。

图1 平昌冬奥会闭幕式场景
熊猫木偶 熊猫木偶高2.35 m,质量仅为10 kg,用铝合金管材和碳纤维条做框架,配合LED灯制作而成。其中,碳纤维是含碳量高于90%的新型材料,密度比铝小,强度比钢大。
智能机器人 中国新一代智能机器人与轮滑舞者共舞、互动,在导航精准性、动作复杂性和灵活性等方面,实现了人工智能领域的升级创新。
石墨烯智能发热服 这种智能发热服可在−20℃的条件下持续发热4 h。石墨烯是一种由碳原子构成的六角型二维碳纳米材料,具有超高硬度、强度和导热系数等特性。
图2 石墨烯微观示意图
请依据以上短文,判断下列说法是否正确(填”对”或”错”)。
(1)熊猫木偶、智能机器人、石墨烯智能发热服展现了”中国智慧”。____
(2)碳纤维具有优良的性能,将有广泛的应用前景。____
(3)中国新一代智能机器人在动作、导航等方面实现了人工智能领域的升级创新。____
(4)石墨烯和石墨由同种元素组成,它们的物理性质相似。____
7.(8分)我国科学家成功合成了含N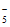 的五氮阴离子盐,这是全氮含能材料研究领域中里程碑式的突破。
的五氮阴离子盐,这是全氮含能材料研究领域中里程碑式的突破。
(1)N在元素周期表中的位置是____。
(2)N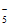 中,N原子之间的相互作用是____(填”离子键”或”共价键”)。
中,N原子之间的相互作用是____(填”离子键”或”共价键”)。
(3)非金属性O强于N,用原子结构解释原因:____,得电子能力O大于N。
(4)砷(As)与氮位于同一主族,下列推断正确的是____(填序号)。
① 砷元素的最低负化合价为−3价
② 热稳定性:AsH3 > NH3
③ 砷的最高价氧化物对应的水化物属于酸
④ As2O3既具有氧化性又具有还原性
8. (8分)加强废旧金属的回收和再利用,是合理开发和利用金属资源的主要途径之一。下图是从镀铜废电路板中回收金属铜的一种工艺流程(各过程需控制适宜条件)。
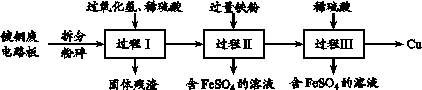
(1)上述流程中,为加快化学反应速率而采取的措施是____。
(2)过程Ⅰ中,Cu溶解,Cu+2H++H2O2==Cu2++2H2O,过氧化氢的作用是____。
(3)过程Ⅱ中,获得Cu的反应的离子方程式为____。
(4)过程Ⅲ的目的是____。
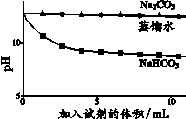
9.(8分)实验小组利用传感器探究Na2CO3和NaHCO3的性质。
【查阅资料】
pH越小,c(OH-)越小,溶液碱性越弱。
【实验过程】
编号 | 实验操作 | 实验数据 |
实 验 Ⅰ | 测量下述实验过程的温度变化
|
|
实 验 Ⅱ | 测量下述实验过程的pH变化
|
|
【分析与解释】
(1)实验Ⅰ中,NaHCO3固体溶解时的热量变化是____(填”放热”或”吸热”)。
(2)实验Ⅱ中,Na2CO3溶液和澄清石灰水反应的化学方程式为____,OH-未参与该反应的实验证据是____。
(3)实验Ⅱ中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,原因是滴加NaHCO3溶液的烧杯中,参与反应的离子有____。
参考答案
第一部分 选择题(共50分)
选择题(每小题2分,共50分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | C | D | A | D | B | D | C | D | B | B |
题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
答案 | A | A | C | D | A | B | D | C | C | B |
题号 | 21 | 22 | 23 | 24 | 25 | |||||
答案 | C | D | B | C | A |
第二部分 非选择题(共50分)
1. (3分)
2. (4分)
(1)③ (2)④ (3)① (4)②
3. (3分) Fe2O3 2 6
4. (4分)
(1)正极
(2)Zn + H2SO4
= ZnSO4
+ H2↑
电流表指针偏转,铜片上有气泡产生
(3) ①③
5.(4分)
(1)湿润的红色布条褪色 (2)I2
(3)尾气处理 Cl2+2OH–==Cl–+ClO–+H2O
(4)Cl2 + H2O=HCl + HClO,HClO具有漂白性,干燥Cl2无漂白性。
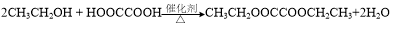 6. (8分)
6. (8分)
(1)对(2)对(3)对(4)错
7. (8分)
(1)第2周期、第VA族
(2)共价键
(3)电子层数O与N相同,核电荷数O大于N,原子半径O小于N;O最外层电子个数为6,N最外层电子个数为5,O更易得电子。
(4)① ③ ④
8. (8分)
(1)粉碎、使用铁粉
(2)作氧化剂
(3)Fe
+ Cu2+
=
Fe2+
+ Cu
(4)去除过量铁粉
9. (8分)
(1)吸热
(2)CO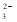 + Ca2+
+ Ca2+
=
CaCO3↓
滴加Na2CO3溶液的pH变化曲线与滴加蒸馏水的基本重合
(3)HCO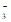 、OH-
、OH-