本试卷分为I卷、II卷两部分,共25个小题,满分100分;答题时间为90分钟
可能用到的相对原子质量: H-1 C-12 O-16
I卷 选择题 (共42分)
选择题(每小题只有一个选项符合题意)
1. 以下各种装置工作时是由化学能转变为电能的是
|
|
|
|
A. 太阳能电池 | B. 风力发电 | C. 氢氧燃料电池 | D. 电解熔融NaCl |
2. 下列物质属于强电解质的是
A. Fe B. NH3 C. H2O D. BaSO4
3. 下图所示为锌铜原电池。下列叙述中正确的是
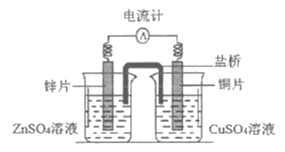
A. 盐桥的作用是传导电子
B. 外电路电流由铜片流向锌片
C. 锌片上发生还原反应
D. 铜片做正极,电极反应是Cu-2e–=Cu2+
4. 25℃时,下列溶液中水的电离程度最小的是
A. 0.01 mol/L醋酸 B. 0.01 mol/L NH4Cl溶液
C. 0.01 mol/L NaHSO4溶液 D. 0.01 mol/L NaHCO3溶液
5. 下列反应中能量变化符合下图且属于氧化还原反应的是
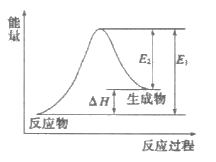
A. C(s)+CO2(g)=2CO(g)
B. CH4(g)+2O2(g)=CO2(g)+2H2O(1)
C. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)
D. Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3(g)+10H2O(1)
6. 对于反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),下列措施能使反应速率加快的是
Fe3O4(s)+4H2(g),下列措施能使反应速率加快的是
A. 恒容通入He气 B. 减小容器容积
C. 增加Fe的质量 D. 降低体系温度
7. 下列方程式书写正确的是
A. S2-+2H2O H2S+2OH– B. NaHCO3
H2S+2OH– B. NaHCO3 Na++HCO3–
Na++HCO3–
C. NH4++H2O=NH3·H2O+H+ D. HClO+H2O H3O++ClO–
H3O++ClO–
8. 下列各组离子能大量共存的是
A. H+、Fe2+、Cr2O72-、SO42- B. Na+、OH–、CO32-、SO32-
C. Na+、Fe3+、Cl–、HCO3– D. Fe3+、K+、SCN–、Cl–
9. 下列事实不能用勒夏特列原理解释的是
A. 将Na2S溶液加入含Hg2+的废水可生成HgS沉淀
B. 将AlCl3溶液加热蒸干灼烧最终得到Al2O3
C. 工业合成氨选择高压而不是常压作为反应条件
D. 用稀H2SO4洗涤BaSO4沉淀,可减少沉淀损失量
10. 下图表示埋在潮湿土壤中的钢管,下列说法正确的是
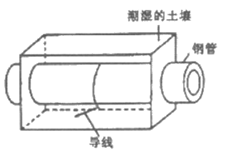
A. 钢管发生电化学腐蚀的负极反应是:Fe-3e–=Fe3+
B. 为防止其腐蚀,可通过导线将钢管与锌块相连
C. 为防止其腐蚀,可通过导线将钢管与直流电源正极相连
D. 为防止其腐蚀,可通过导线将钢管与铜块相连
11. 用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) △H=-115.6 kJ/mol恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能说明该反应达到化学平衡状态的是
2Cl2(g)+2H2O(g) △H=-115.6 kJ/mol恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能说明该反应达到化学平衡状态的是
A. 混合气体的密度保持不变
B. 单位时间内消耗n molO2,同时生成2n mol Cl2
C. 断开4 mol H-Cl键的同时断裂4mol H-O 键
D. n(HCl):n(O2):n(Cl2):n(H2O)=4:1:2:2
12. 25℃时,下列事实不能说明一水合氨是弱电解质的是
A. 醋酸铵溶液 pH=7 B. 0.01 mol·L-1 氨水pH约为10
C. 氯化铵溶液可以除铁锈 D. 氨水与氯化铁溶液混合产生沉淀
13. 某小组用下图装置模拟电镀铜和精炼铜。下列说法不正确的是
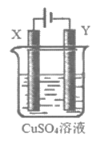
A. 电镀铜和精炼铜时,Y上的电极反应都是Cu2++2e–=Cu
B. 电镀铜时,Y电极为待镀的金属制品
C. 精炼铜时,X电极是粗铜,比铜活泼的金属最终变成阳极泥
D. 电镀铜时,X电极是铜,溶液中的Cu2+浓度不变
14. 解释下列过程的离子方程式不正确的是
A. K2Cr2O7溶液中加入浓NaOH溶液后变黄:Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
B. 明矾溶于水产生Al(OH)3胶体:Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
C. 用碳酸钠溶液处理锅炉水垢中的硫酸钙:
CaSO4+CO32- CaCO3+SO42-
CaCO3+SO42-
D. Ca(HCO3)2溶液中滴加少量NaOH溶液生成白色沉淀:
Ca2++2HCO3–+2OH–=CaCO3↓+CO32-+2H2O
15. 在2L密闭容器中,3mol A和1mol B发生反应:3A(g)+B(g) 2C(g)+2D(g),10s末时,生成1.2 mol C,下列说法正确的是
2C(g)+2D(g),10s末时,生成1.2 mol C,下列说法正确的是
A. 10s内,v(D)=0.12 mol/(L·s)
B. 10s末时,物质A的转化率为60%
C. 10s末时,B的浓度为0.4 mol/L
D. 10s末时,C的物质的量分数为15%
16. 铅蓄电池反应原理为:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(1),下列说法正确的是
2PbSO4(s)+2H2O(1),下列说法正确的是
A. 放电时,正极附近pH减小
B. 充电时,铅蓄电池的负极连接电源的正极
C. 放电时,Pb上的电极反应式:Pb-2e–=Pb2+
D. 充电时,阴极的电极反应式为:PbSO4+2e–=Pb+SO42-
17. 下列实验方案中能达到相应实验目的的是
A | B | C | D | |
方 案 |
|
|
|
将NO2球分别浸泡在冷水和热水中 |
目 的 | 证明AgI比AgCl更难溶 | 探究浓度对化学反应速率的影响 | 测定溶液的pH | 探究温度对化学反应速率的影响 |
18. 25℃时,向20 mL 0.1 mol/L NaOH溶液中逐滴加入0.1 mol/L 醋酸溶液,滴定曲线如下图所示。下列说法正确的是
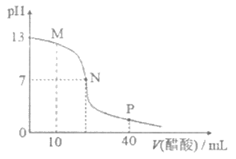
A. 该NaOH溶液中水电离出的c(OH–)=10-12 mol·L-1
B. M点时,c(CH3COO–)>c(Na+)>c(OH–)>c(H+)
C. 在P点c(CH3COO–)+c(CH3COOH)=2c(Na+)
D. N点对应的横坐标是20
19. 反应m Y(g)+n Z(g) q X(g) △H,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法正确的是
q X(g) △H,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法正确的是
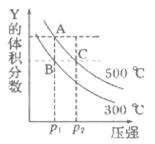
A. m+n<q
B. 该反应的△H>O
C. A、C两点化学平衡常数:KA>KC
D. B、C两点的反应速率:v(B)<v(C)
20. 25℃时,下列各溶液中微粒物质的量浓度关系不正确的是
A. pH=10的Na2CO3溶液:c(OH–)=c(HCO3–)+c(H+)+2c(H2CO3)
B. pH=13的氨水与pH=1的盐酸等体积混合:c(Cl–)>c(NH4+)>c(H+)>c(OH–)
C. pH=7的Na2C2O4和NaHC2O4混合溶液:c(Na+)=2c(C2O42-)+c(HC2O4–)
D. 浓度均为0.2 mol/L 的NH4Cl溶液与NaOH溶液等体积混合:
c(Na+)=c(Cl–)>c(OH–)>c(NH4+)
21. 25℃时,pH=2的盐酸和醋酸各1 mL分别加水稀释,pH随溶液体积变化的曲线如下图所示。下列说法正确的是
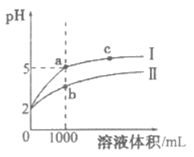
A. 曲线I代表醋酸的稀释过程
B. a溶液的导电性比c溶液的导电性差
C. 将a、b两溶液加热至30℃(忽略溶质挥发),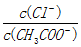 变大
变大
D. 与相同浓度的NaOH溶液恰好中和时,消耗a溶液的体积比b溶液的体积大
II卷 非选择题 (共58分)
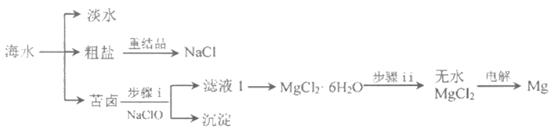
22. 海水是一个巨大的化学资源宝库。
(1)海水中制得的氯化钠可用于生产烧碱及氯气,装置如图所示,下列说法正确的是_________(填字母)。
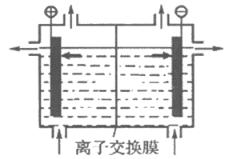
A. 阴极反应式是:Na++e–=Na
B. 可以用铁做阴极,石墨做阳极
C. 烧碱和氯气都在阳极生成
D. 离子交换膜是阴离子交换膜
(2)苦卤的主要成分是MgCl2,此外还含Fe2+、Fe3+、Al3+等离子。
已知:生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Al(OH)2 | 3.7 | 4.7 |
Mg(OH)2 | 9.6 | 11.1 |
①步骤i中加入NaClO的作用是________________,________________。
②步骤ii需在HCl保护气中加热进行,HCl保护气的作用是________________。
③若向苦卤中加入石灰乳,可以得到Mg(OH)2沉淀,用化学平衡移动原理解释该反应过程________________________________。
(3)海水淡化前需对海水进行预处理。用下图所示NaClO的发生装置对海水进行消毒和灭藻处理。
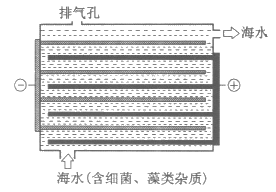
①装置中由NaCl转化为NaClO的离子方程式是________________,________________。
②定量测定排出海水中Cl2和ClO–的含量。已知:2S2O32-+I2=S4O62-+2I–。取25.00 mL排出的海水,加入过量KI溶液,然后用a mol/L Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液b mL。该滴定操作选择的指示剂是__________,通过计算可知海水中Cl2和ClO–的总物质的量浓度是________________mol/L。
23. SO2经一系列反应可以得到硫酸和芒硝(Na2SO4·10 H2O),其转化关系如下:
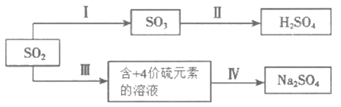
(1)SO2可用于制H2SO4。已知25℃、101 kPa时:
2SO2(g)+O2(g)+2H2O(1)=2H2SO4(1) △H1=-456 kJ/mol
SO3(g)+H2O(1)=H2SO4(1) △H2=-130 kJ/mol
则I中SO2(g)→SO3(g)的热化学方程式是________________________。
(2)若III中将SO2通入NaHCO3溶液中,则反应的离子反应方程式是______________。
已知:25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10-11
H2SO3电离平衡常数K1=1.5×10-2 K2=6.0×10-8
(3)若III中将SO2通入NaOH溶液中,得到NaHSO3溶液,用化学用语表示NaHSO3在水溶液中存在的可逆过程_________。25℃时,SO2与NaOH溶液反应后的溶液中,含硫各微粒(H2SO3、HSO3–和SO32-)的物质的量分数X(i)与溶液pH的关系如下图所示,下列说法不正确的是__________(填字母)。
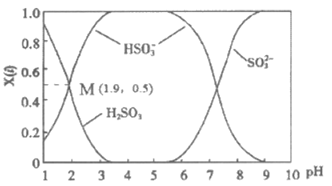
A. 为获得更多的NaHSO3,应将溶液的pH控制在4~5
B. pH=3时,溶液中c(HSO3–)>c(H2SO3)>c(SO32-)
C. 由M点坐标,可以计算H2SO3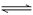 H++HSO3–的电离常数
H++HSO3–的电离常数
D. pH=9时,溶液中存在c(H+)=c(HSO3–)+2c(SO32-)+c(OH–)
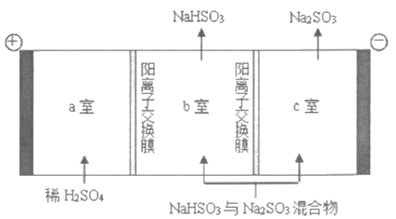
(4)通过电解法可分离NaHSO3与Na2SO3混合物,如下图所示,结合化学用语解释c室只排出Na2SO3的原因_______________。
(5)步骤IV可以将NaHSO3转化为Na2SO4的试剂是___________,___________(任意写两种)。
24. CO2可用于合成多种化工原料。用CO2生产绿色燃料甲醇时发生反应A:
CO2(g)+3H2(g)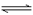 CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
(1)反应A的平衡常数表达式是___________。在恒容恒温的容器中,下列说法正确的是___________(填字母)。
A. 反应达到平衡时,容器的总压强不再改变
B. 加入合适的催化剂,可以提高CO2的转化率
C. 将初始投料增加1倍,可以提高CO2的转化率
D. 充入一定量的He气,可以提高CO2的转化率
(2)在体积为1 L的恒容密闭容器中发生反应A,下图是在三种投料[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对CO2平衡转化率影响的曲线。
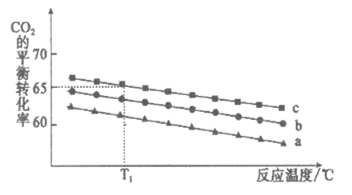
①反应A的△H1__________0(填”>”或”<“)。
②曲线c对应的投料是_____________。
③T1℃时,曲线c对应的化学平衡常数__________1(填”大于”、”小于”或”等于”)。
(3)在一定条件下,利用CO2合成CH3OH的反应过程中会有副反应:
CO2(g)+H2(g)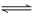 CO(g)+H2O(g)。压强一定时,将初始投料比一定的CO2和H2按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对CH3OH、CO的产率影响如图1所示,温度对CO2的转化率影响如图2所示。
CO(g)+H2O(g)。压强一定时,将初始投料比一定的CO2和H2按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对CH3OH、CO的产率影响如图1所示,温度对CO2的转化率影响如图2所示。
由上图可知,升高温度,CO2的实际转化率提高而甲醇的产率降低,其原因是___________。
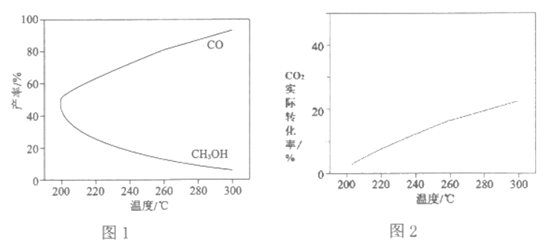
(4)以CO2和H2O为原料合成CH4,可以借助氮化镓(GaN)与Cu组成的人工光合系统,装置如图所示。
①Cu电极上的电极反应式是________________。
②当有0.4 mol电子转移时,铜电极上生成的CH4在标准状况下的体积是____________L。
25. 某兴趣小组探究溶液的pH对KI与O2反应的影响,实验如下。
装置 | 烧杯中的液体 | 现象 |
| ①2 mL1 mol/L KI溶液+5滴淀粉 | 5分钟后无明显变化 |
②2 mL 1 mol/L KI溶液+5滴淀粉 +2 mL 0.2 mol/L HCl溶液 | 5分钟后溶液变蓝 | |
③2 mL 1 mol/L KI溶液+5滴淀粉 +2 mL 0.2 mol/L KCl溶液 | 5分钟后无明显变化 | |
④2mL pH=8.5 混有KOH的1 mol/L KI溶液+5滴淀粉 | 5小时后溶液才略变蓝 | |
⑤2 mL pH=10 混有KOH的1 mol/L KI溶液+5滴淀粉 | 5小时后无明显变化 |
(1)实验①中无现象,可能的原因是①KI与O2不反应,②________________。
(2)若放置5小时后,实验①溶液变蓝,则反应的离子方程式是_____________。
(3)去掉实验③,对该探究过程___________(填”有”或”没有”)影响。
(4)对比实验②和实验④,可以得出的结论是__________________________。
(5)对于实验⑤的现象,甲同学提出猜想”pH=10时O2不能氧化I–“,设计了下列装置进行实验⑥,验证猜想。
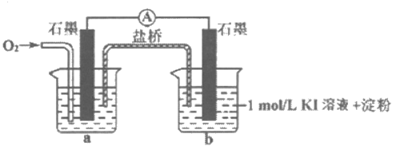
①烧杯a中的溶液为_____________。
②实验结果是b中溶液变蓝,此猜想不成立。通入O2后,a中的电极反应式是__________。
③实验⑥的结果说明实验⑤中”无明显现象的原因”是____________。
参考答案
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
C | D | B | C | A | B | D | B | A | B | |
11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
C | D | C | D | B | D | B | C | D | B | D |
22. (16分)
(1)B。(2分)
(2)①把Fe2+氧化成Fe3+,调pH(至4.7~9.6)。(各1分,共2分)
②防止MgCl2水解(成Mg(OH)2)。(2分)
③Ca(OH)2(s) Ca2+(aq)+2OH–(aq),Mg2+与OH–生成Mg(OH)2沉淀,OH–浓度减小,平衡正向移动。(2分)
Ca2+(aq)+2OH–(aq),Mg2+与OH–生成Mg(OH)2沉淀,OH–浓度减小,平衡正向移动。(2分)
(3)①2Cl–+2H2O Cl2+H2+2OH– (2分),Cl2+2OH–=Cl–+ClO–+H2O (2分)。
Cl2+H2+2OH– (2分),Cl2+2OH–=Cl–+ClO–+H2O (2分)。
②淀粉溶液 (2分),ab/50 (2分)。
23. (12分)
(1)2SO2(g)+O2(g)=2SO3(g) △H=-196kJ/mol。 (2分)
(2)SO2+HCO3–=HSO3–+CO2。(2分)
(3)HSO3–+H2O H2SO3+OH–,HSO3–
H2SO3+OH–,HSO3– SO32-+H+。(2分)
SO32-+H+。(2分)
D。(2分)
(4)2H++e–=H2,H+浓度降低,使HSO3– SO32-+H+平衡正向移动,Na+通过离子交换膜进入c室,最终生成Na2SO3。(2分)
SO32-+H+平衡正向移动,Na+通过离子交换膜进入c室,最终生成Na2SO3。(2分)
(5)H2O2,Cl2。(合理的强氧化剂即得分)(各1分,共2分)
24. (16分)
(1) 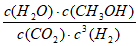 (2分)。AC。(2分)
(2分)。AC。(2分)
(2)① < 。(2分)
② [1mol,6mol] 。(2分)
③ 小于 。(2分)
(3)升高温度,反应B(副反应)的速率比反应(A)快。(2分)
(4)①2H2O-4e–=O2+4H+。(2分)
②1.12 。(2分)
25. (14分)
(1)ii KI与O2反应速率慢(或者限度小) 。(2分)
(2)4I–+O2+2H2O=I2+4OH–。(2分)
(3)有。(2分)
(4)KI与O2反应在酸性条件下反应速率比碱性条件下快。(2分)
(5)i. pH=10的KOH溶液 。(2分)
ii. O2+2H2O+4e–=4OH– 。(2分)
iii. ⑤中生成的I2与OH–反应 。(2分)