本试卷分为选择题和非选择题两部分,满分100分。考试时间90分钟。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Ge-73
第I卷(选择题
共42分)
本部分共14个小题,每小题3分,每小题只有一个选项符合题意
1. 我国科技事业成果显著,下列成果所涉及的材料不属于金属材料的是
A. “C919”飞机的主体材料——铝合金
B. 航天员宇航服的材料——聚酯纤维
C. 我国第一艘航空母舰的主体材料——合金钢
D. “奋斗者“号深潜器载人舱的外壳——钛合金
2. 与下列物质反应时,HCl表现出还原性的是
A. MnO2 B. Na2CO3 C. Zn D. AgNO3
3. 下列工业生产中不涉及氧化还原反应的是
A. 合成氨 B. 制漂白粉 C. 冶炼Fe D. 煅烧石灰石
4. 下列化学用语书写正确的是
A. 中子数为7的碳原子是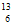 C B. N2的电子式是N
C B. N2的电子式是N N
N
C. 钠离子的结构示意图是 D. 乙烯的结构简式是CH2CH2
D. 乙烯的结构简式是CH2CH2
5. 2020年有科学家通过观察金星的酸性云层,分析出金星存在磷化氢气体,从而推测金星可能存在生命的迹象。下列说法不正确的是
A. 非金属性P<O B. 热稳定性:NH3>PH3
C. 酸性:H2SO4>H3PO4 D. 原子半径大小:P<S
6. 下列解释实验事实的反应方程式正确的是
A. 硫酸铜溶液显酸性:Cu2++2H2O=Cu(OH)2↓+2H+
B. 用烧碱溶液吸收氯气:Cl2+2OH–=Cl–+ClO–+H2O
C. 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
D. 溴化亚铁溶液中通入足量氯气:2Fe2++2Br–+2Cl2=2Fe3++Br2+4Cl–
7. 化学知识无处不在,下列家务劳动不能用对应的化学知识解释的是
选项 | 家务劳动 | 化学知识 |
A | 用温热的纯碱溶液清洗油污 | 油脂在热的纯碱溶液中更易发生水解 |
B | 白醋除去水垢中的CaCO3 | 醋酸酸性强于碳酸 |
C | “84消毒液“稀释后拖地 | 利用NaClO的还原性消毒杀菌 |
D | 餐后将洗净的铁锅擦干 | 减缓铁的锈蚀 |
8. 下列各项比较中,相等的是
A. 相同物质的量的Na2O和Na2O2所含阴离子数
B. 标准状况下,相同体积的乙炔和苯中所含的氢原子数
C. 相同物质的量浓度的NH4Cl和NH3·H2O溶液中的c(NH4+)
D. 相同质量的NO和NO2所含氮原子数
9. 硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示。下列说法正确的是
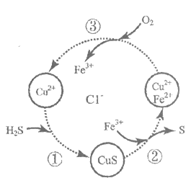
A. 过程①中,生成CuS的反应为S2-+Cu2+=CuS↓
B. 过程②中,Fe3++Cus=Cu2++Fe2++S
C. 过程③中,溶液的酸性增强
D. 回收S的总反应为2H2S+O2 2H2O+2S↓
2H2O+2S↓
10. 光刻胶是光刻机制造芯片必不可少的重要材料。一种光刻胶是由降冰片烯 与马来酸酐
与马来酸酐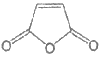 共同加成聚合(共聚)而成。下列说法不正确的是
共同加成聚合(共聚)而成。下列说法不正确的是
A. 降冰片烯分子式为C7H10,其分子本身可以发生加聚反应
B. 该光刻胶的结构简式可能为: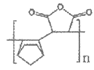
C. 1mol马来酸酐,最多消耗1 mol NaOH
D. 光刻胶合成过程中可能会出现链节: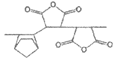
11. 1,3-丁二烯和Br2以物质的量之比为1:1发生加成反应分两步:第一步Br+进攻1,3-丁二烯生成中间体C(溴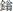 正离子);第二步Br–进攻中间体C完成1,2-加成或1,4-加成。反应过程中的能量变化如下图所示,下列说法正确的是
正离子);第二步Br–进攻中间体C完成1,2-加成或1,4-加成。反应过程中的能量变化如下图所示,下列说法正确的是
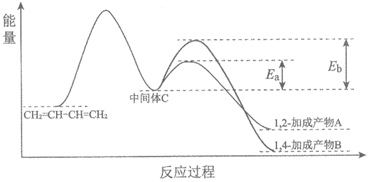
A. 1,2-加成产物A比1,4-加成产物B稳定
B. 第一步的反应速率比第二步慢
C. 该加成反应的反应热为Eb-Ea
D. 升高温度,1,3-丁二烯的平衡转化率增大
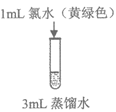
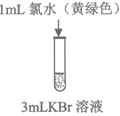
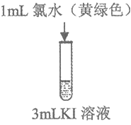
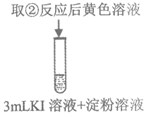
12. 验证氧化性强弱Cl2>Br2>I2,设计如下实验(已知:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色;忽略氧气的影响)
实验① | 实验② | 实验③ | 实验④ |
|
|
|
|
溶液变为浅黄绿色 | 溶液变为黄色 | 溶液变为棕黄色 | 溶液变为蓝色 |
下列说法不正确的是
A. 实验①设计目的为:排除实验②③④水稀释的影响
B. 实验②发生反应为:2Br–+Cl2=Br2+2Cl–
C. 实验③的现象可以证明氧化性;Cl2>I2
D. 实验④能证明氧化性:Br2>I2
13. 已知:H2(g)+CO2(g)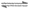 H2O(g)+CO(g)
H2O(g)+CO(g)
△H>0,T1温度时的平衡常数K=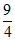 。T1、T2温度时,在①、②、③、④四个相同体积的恒容容器中投料,起始浓度如下表所示。下列判断不正确的是
。T1、T2温度时,在①、②、③、④四个相同体积的恒容容器中投料,起始浓度如下表所示。下列判断不正确的是
温 度 | 容器 编号 | 起始浓度/mol·L-1 | |||
H2 | CO2 | H2O | CO | ||
T1 | ① | 0. 1 | 0. 1 | 0 | 0 |
② | 0. 2 | 0. 1 | 0 | 0 | |
③ | 0. 1 | 0. 2 | 0. 1 | 0. 1 | |
T2 | ④ | 0. 04 | 0. 04 | 0. 06 | 0. 06 |
A. 容器①5 min达到平衡,用H2表示的化学反应速率为:0.012 mol·L-1·min-1
B. H2的平衡转化率:①>②
C. 容器③中反应向逆反应方向进行
D. 容器④中反应向正反应方向进行,则T2>T1
14. 有人建议用AG来表示溶液的酸度,AG的定义式为AG=lg[c(H+)/c(OH–)],室温下实验室用0.01 mol/L的氢氧化钠溶液滴定20mL 0.01mol/L的醋酸溶液,滴定曲线如图所示,下列有关叙述不正确的是
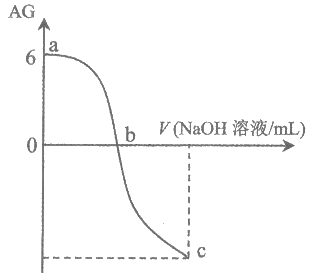
A. 在一定温度下,溶液酸性越强,AG越大
B. 由图知:室温时0.01mol/L的醋酸溶液的pH=4
C. ab段溶液中:c(CH3COO–)>c(CH3COOH)
D. c点溶液中:c(CH3COO–)+c(OH–)=c(H+)+c(Na+)
第II卷(非选择题
共58分)
本部分共5小题,共58分
15. (14分)某研究小组以甲苯为起始原料,按下列路线合成利尿药美托拉宗。
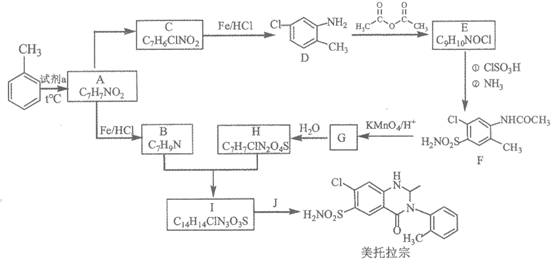
已知:i.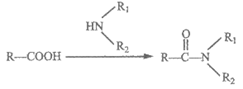
ii.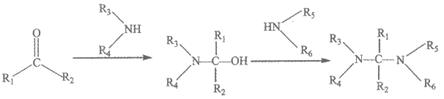
请回答下列问题:
(1)试剂a是_________。
(2)C→D的反应类型是_________。
(3)D→E的化学方程式是_________。
(4)属于芳香族化合物的B的同分异构体有_________个(提示:不包括B)。
(5)写出B+H→I的化学方程式_________。
(6)从D→H的流程看,D→E的主要目的是_________。
(7)有人认为由I合成美托拉宗的过程如下:
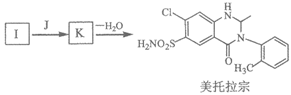
请写出J的结构简式________,K的结构简式________。
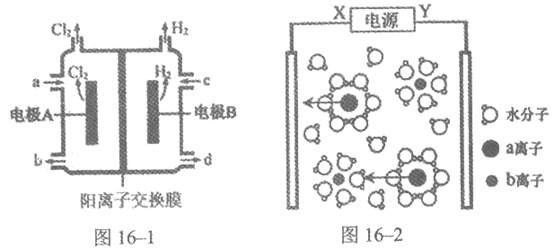
16. (10分)海水是巨大的化学资源宝库,利用海水可以直接或间接获取很多物质。
利用1:氯碱工业
(1)从海水中提取粗盐的方法是________。
(2)图16-1是氯碱工业中电解饱和氯化钠溶液的示意图,饱和氯化钠溶液从a口进入,NaOH溶液从________(填b或d)口导出。阳离子交换膜的作用是________。
(3)图16-2是电解氯化钠溶液的微观示意图。X为电源的________极,水合钠离子、水合氯离子吸引水分子的氢原子朝向不同的原因________。
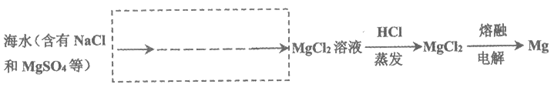
利用2:提镁工业
(4)从海水中提取镁的流程图如下,按示例所示补全缺少的流程:
17. (10分)门捷列夫在研究周期表时预言了“类硅“元素锗和“类铝“元素镓等11种元素。锗及其化合物应用于航空航天测控、光纤通讯等领域。一种提纯二氧化锗粗品(主要含GeO2、As2O3)的工艺如下:
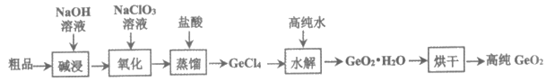
已知:i. GeO2与碱反应生成Na2GeO3。
ii. GeCl4极易水解,GeCl4沸点86.6℃。
iii. As位于同主族P的下一周期,As2O3+2NaOH=2NaAsO2+H2O。
(1)Ge位于同主族Si的下一周期,则Ge在周期表中的位置是________。
(2)从原子结构角度解释Ge和Si金属性递变的原因________。
(3)“氧化“过程是将NaAsO2氧化为Na3AsO4,其离子方程式为________。
(4)加盐酸蒸馏生成GeCl4,反应的化学方程式为________。
(5)高纯二氧化锗的含量采用碘酸钾滴定法进行测定。称取ag高纯二氧化锗样品,加入氢氧化钠在电炉溶解,用次亚磷酸钠还原为Ge2+,以淀粉为指示剂,用b mol/L的碘酸钾标准溶液滴定,消耗碘酸钾的体积为VmL。(20℃以下,次亚磷酸钠不会被碘酸钾和碘氧化)
资料:3Ge2++IO3–+6H+=3Ge4++I–+3H2O,IO3–+5I–+6H+=3I2+3H2O。
此样品中二氧化锗的质量分数是________(用表达式表示)。
18. (10分)氮肥厂的废水中氮元素以NH3·H2O、NH3和NH4+的形式存在,对氨氮废水无害化处理已成为全球科学研究热点,下面是两种电化学除氨氮的方法。
方法一:电化学氧化法
(1)有研究表明,当以碳材料为阴极,O2可在阴极生成H2O2,并进一步生成氧化性更强的·OH,·OH可以将水中氨氮氧化为N2。
①写出·OH的电子式________。
②写出·OH去除氨气的化学反应方程式________。
③阴极区加入Fe2+可进一步提高氨氮的去除率,结合图18-1解释Fe2+的作用________。
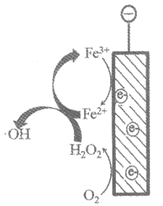
图18-1
方法二:电化学沉淀法
已知:常温下MgNH4PO4·6H2O、Mg3(PO4)2和Mg(OH)2的溶度积如下
物质 | MgNH4PO4·6H2O | Mg3(PO4)2 | Mg(OH)2 |
溶度积 | 2. 5×10-13 | 1. 04×10-24 | 1.8×10-11 |
(2)用0. 01mol/L NH4H2PO4溶液模拟氨氮废水,电解沉淀原理如图18-2,调节溶液初始pH=7,氨氮的去除率和溶液pH随时间的变化情况如图18-3。
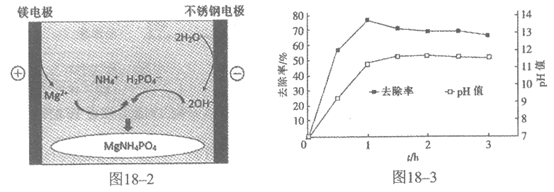
①用化学用语表示磷酸铵镁沉淀的原理:Mg-2e–=Mg2+,_____(补全反应)。
②反应1h以后,氨氮的去除率随时间的延长反而下降的原因_____。
19. (14分)实验小组探究FeCl3溶液灼烧的变化。
已知:FeO是一种黑色粉末,不稳定,在空气中加热,可被氧化成Fe3O4,隔绝空气加热会歧化为Fe和Fe3O4。
I. FeCl3溶液的灼烧。
实验i:将一只白粉笔浸泡在FeCl3溶液中,用坩埚钳夹持粉笔于酒精灯上灼烧,很快观察到粉笔表面颜色的变化:黄色→红褐色→铁锈色→黑色。
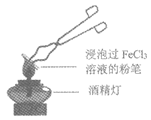
(1)配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度。结合化学用语解释将氯化铁晶体溶于盐酸的目的________。
(2)“黄色→红褐色→铁锈色→黑色“颜色变化中的“铁钱色“物质是________。(填化学式)
(3)针对“黑色“物质,小组成员提出猜想。
猜想1:酒精灼烧粉笔的产物:猜想2:酒精还原“铁锈色“物质得到的产物。通过实验排除了猜想①,实验操作和现象是________。
Ⅱ. 探究“黑色“物质的成分。
实验ii:先用酒精蒸气排尽装置中的空气,再在“铁锈色“物质处加热,充分反应至“铁锈色“物质完全变成“黑色“物质。取下装有新制Cu(OH)2的试管,加热,有砖红色沉淀生成。
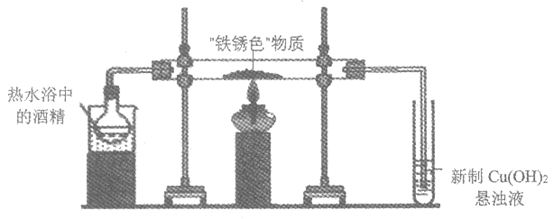
实验iii:在“黑色“物质中加入热的硫酸,“黑色“物质溶解,无气泡产生。
(4)甲同学根据实验ii和iii的现象,判断“黑色“物质中含有二价铁,其理由是________。
(5)乙同学用实验iii中所得溶液进行实验iv,证实了甲的判断,实验iv的离子反应方程式为________。
(6)丙同学发现“黑色“物质完全被磁铁吸引,推测“黑色“物质是Fe3O4,写出“红色“物质变成Fe3O4的化学方程式________。
(7)丁同学为证明“黑色“物质是Fe3O4,设计实验方案并预测:取实验iii中少量清液滴入足量的Na2S溶液,认为得到物质的量之比为3:1的FeS和S沉淀,即可证明。你认为是否合理,并说明理由________。
参考答案
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | B | A | D | A | D | B | C | A | D | C | B | D | C | C |
阅卷说明:
1. 化学方程式评分标准:
(1)化学(离子)方程式中,离子方程式写成化学方程式2分的给1分;化学方程式写成离子方程式的不扣分。
(2)反应物、生成物化学式均正确得1分,有机反应核心物质对可以给1分。
(3)不写条件或未配平,按要求看是否扣分;不写“↑“或“↓“不扣分。
2. 简答题中加点部分为给分点。简单题逻辑合理给分。
15. (14分)(除标明的外,其余均为2分)
(1)浓硝酸,浓硫酸
(2)还原反应(1分)
(3)
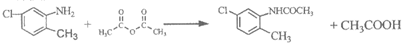
(4)4
(5)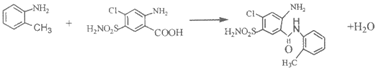
(6)保护与苯环直接相连的氨基不被酸性高锰酸钾氧化
(7)CH3CHO 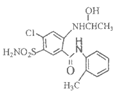 (1分,其它合理答案均可)
(1分,其它合理答案均可)
16. (10分)(除标明的外,其余均为2分)
(1)蒸发结晶或晒盐
(2)d(1分)。阻止OH–移向阳极,提高NaOH的产量和纯度
(3)正(1分),钠离子带正电易吸引水中的氧原子,氯离子带负电易吸引水中的氢原子
(4)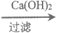 Mg(OH)2
Mg(OH)2 (NaOH也可以)
(NaOH也可以)
17. (10分)(每空2分)
(1)第四周期,第IVA族
(2)Ge与Si属于同主族元素,Ge比Si多一层,原子半径增大,失去电子能力增强,金属性增强
(3)3AsO2–+ClO3–+6OH–=3AsO4–+Cl–+3H2O
(4)Na2GeO3+6HC1=2NaCl+GeCl4+3H2O
(5)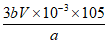 (化简与否均正确)
(化简与否均正确)
18.(10分)(每空2分)
(1)①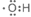
②6·OH+2NH3=N2+6H2O
③催化作用。或具体描述:H2O2+Fe2++H+= Fe3+·OH+OH–,Fe3+向阴极移动,阴极Fe3++e–=Fe2+,Fe2+再生,循环使用
(2)①2H2O+2e–=2OH–+H2↑,Mg2++2OH–+NH4++H2PO4–=MgNH4PO4↓+2H2O
②反应1h后,随着溶液中c(Mg2+)和c(OH–)的增大,会形成Mg3(PO4)2或Mg(OH)2沉淀,同时,碱性条件下生成的MgNH4PO4·6H2O沉淀会部分转化为Mg3(PO4)2或Mg(OH)2沉淀,释放铵根离子,使溶液中氨氮的去除率下降。
19. (14分)(每空2分)
(1)FeCl3+3H2O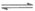 Fe(OH)3+3HCl溶于较浓的盐酸中的目的是抑制其水解。
Fe(OH)3+3HCl溶于较浓的盐酸中的目的是抑制其水解。
(2)Fe2O3
(3)把洁净的粉笔置于酒精灯上灼烧未呈现黑色
(4)实验ii中酒精被氧化成乙醛,红色物质Fe2O3中Fe元素即被还原成0价或+2价,实验iii中无气泡生成,可说明黑色物质中没有Fe单质,则一定含有+2价铁元素。(逻辑合理即可)
(5)5Fe2++8H++MnO4–=Mn2++5Fe3++4H2O
或3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓
(6)CH3CH2OH+3Fe2O3 CH3CHO+2Fe3O4+H2O
CH3CHO+2Fe3O4+H2O
(7)合理;根据产物FeS和S物质的量比为3:1,可知实验中发生了2Fe3++3S2-=2FeS+S和Fe2++S2-=FeS两个反应,进而可知实验iii所得清液中n(Fe3+):n(Fe2+)=2:1,由此可判断黑色物质是Fe3O4。(逻辑合理即可)
不合理;实验中Fe3+与Na2S溶液还可能发生2Fe3++3S2-=2Fe2S3↓和2Fe3++3S2-+6H2O=2Fe(OH)3↓+3H2S↑等反应。(逻辑合理即可)