本调研卷满分100分,考试时间90分钟。
可能用到的相对原子质量:H 1 C12 N14 O16 Si 28 Cl 35. 5
第一部分
选择题(共40分)
每小题2分。在每小题列出的四个选项中,选出最符合题目要求的一项。
1. 下图为空气成分示意图(按体积计算),其中“a”代表的是
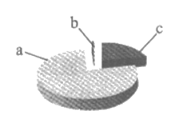
A. 氧气 B. 氮气 C. 二氧化碳 D. 稀有气体
2. 下列物质含金属元素的是
A. H2S B. P2O5 C. AgNO3 D. H2O
3. 下列属于铁丝在氧气中燃烧的现象的是
A. 发出黄色火焰 B. 生成有刺激性气味的气体
C. 产生大量白烟 D. 生成黑色固体
4. 下列安全图标表示“禁止燃放鞭炮“的是

5. 下列操作不正确的是
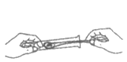
A. 称量固体 B. 加热液体 C. 点燃酒精灯 D. 取用固体粉末
6. 下列做法不利于保护环境的是
A. 垃圾分类处理 B. 倡导使用一次性筷子
C. 使用节水龙头 D. 乘坐公共交通工具
7. 下列不属于新能源的是
A. 潮汐能 B. 太阳能 C. 风能 D. 化石能源
8. 下列材料属于合金的是
A. 不锈钢 B. 塑料 C. 玻璃 D. 陶瓷
9. 下列饮品属于溶液的是
A. 蔗糖水 B. 牛奶 C. 果粒橙 D. 豆浆
10. 下列物质含有氢分子的是
A. H2 B. H2O2 C. H2CO3 D. N2H4
11. 下列物质的用途中,利用其物理性质的是
A. 氧气用于炼钢 B. 干冰用作制冷剂
C. 乙醇用作燃料 D. 氮气用作保护气
12. 铝是地壳中含量最高的金属元素。元素周期表中铝元素的信息如下图所示。下列关于铝原子的说法不正确的是
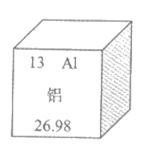
A. 核电荷数为13 B. 质子数为13
C. 核外电子数为13 D. 相对原子质量为13
13. 用H2O2溶液和MnO2制取O2时,一定不会用到的仪器是

14. 下列关于空气的说法正确的是
A. 空气是由空气分子构成的
B. 空气中氮气、氧气等分子均匀地混合在一起
C. 空气中的氮气、氧气不再保持各自的化学性质
D. 空气经液化、蒸发获得氧气的过程中,氮分子变成氧分子
15. 下列灭火措施对应的灭火原理正确的是
选项 | 灭火措施 | 灭火原理 |
A | 用灯帽盖灭酒精灯 | 降低着火点 |
B | 风将蜡烛吹灭 | 隔绝空气 |
C | 用锅盖盖灭着火的油锅 | 降低温度至着火点以下 |
D | 将树木砍掉形成隔离带,扑灭森林火灾 | 移除可燃物 |
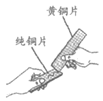
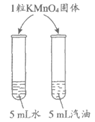
16. 下列实验不能达到实验目的的是
选项 | A | B | C | D |
实验 操作 |
|
|
|
|
实验 目的 | 比较CO2和O2的密度 | 比较纯铜和黄铜的硬度 | 除去水中的泥沙 | 比较KMnO4在水和汽油中的溶解性 |
17. 下列关于N2+O2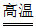 2NO的说法不正确的是
2NO的说法不正确的是
A. 表示氮气和氧气在高温条件下生成一氧化氮
B. 该反应属于化合反应
C. 反应前后原子数目不变
D. 参加反应的氮气与氧气的质量比为1:1
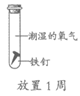
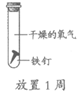
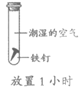
18. 为探究铁生锈的影响因素,某兴趣小组做了如下实验。
序号 | ① | ② | ③ | ④ |
实验 |
|
|
|
|
现象 | 铁钉表面灰暗 | 铁钉表面光亮 | 铁钉表面光亮 | 铁钉表面光亮 |
下列说法正确的是
A. ①说明铁生锈与氧气和水都有关
B. ②③说明铁生锈与氧气有关
C. ①②说明铁生锈与水有关
D. ①④说明铁生锈与氧气浓度有关
19. 在食品、药品包装中使用干燥剂,可防潮、防霉、除湿。化学干燥剂,如氧化钙干燥剂是通过与水发生化学反应而吸水;物理干燥剂,如硅胶干燥剂的内部为多孔结构,可以吸附水。下列说法不正确的是
A. 干燥剂的使用可以防潮、防霉、除湿
B. 氧化钙干燥剂吸水,水分子的数目发生了改变
C. 硅胶干燥剂吸水,水分子的种类发生了改变
D. 干燥剂吸水,既可以利用物理变化,也可以利用化学变化
20. 乙烷(C2H6)是重要的化工原料,与氯气反应前后分子种类变化的微观示意图如下。下列说法正确的是
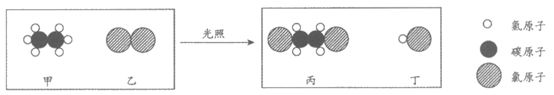
A. 甲中碳、氢元素质量比为1:3
B. 乙的相对分子质量为71
C. 甲和丙的元素组成相同
D. 生成丙与丁的分子个数比为1:1
第二部分
非选择题(共60分)
【生活现象解释】
21. (4分)2020年全国低碳日的活动主题是“绿色低碳,全面小康“。

(1)CO2属于__________(填序号)。
a. 单质 b. 氧化物 c. 化合物
(2)CO2过度排放会导致的环境问题有__________(写出1条即可)。
(3)减少化石燃料的使用可控制CO2的排放量。
①化石燃料包括天然气、煤和__________。
②天然气的主要成分是CH4,CH4完全燃烧的化学方程式为__________。
22. (2分)水是宝贵的资源。
(1)生活中,常用来降低水的硬度的方法是__________。
(2)我国开发出一种新型催化剂,实现了在光照下分解水,反应的化学方程式为__________。
23. (2分)烧烤中蕴含着丰富的化学原理。

(1)用扇子扇炭火,可以让炭火更旺,原因是__________。
(2)食物烤制过程中香味四溢,从微观角度解释能闻到香味的
原因:__________。
24. (4分)铁是全世界年产量最高的金属。
(1)用一氧化碳和赤铁矿(主要成分是Fe2O3)炼铁的原理是__________(用化学方程式表示)。
(2)铁锅可以用来炒菜,主要利用的铁的性质是__________。
(3)波尔多液是一种农业上常用的杀菌剂,它由硫酸铜、生石灰加水配制而成。不能用铁桶配制波尔多液的原因是__________(用化学方程式表示)。
(4)铁生锈的现象随处可见。防止铁生锈的措施有_________(写出1条即可)
【科普阅读理解】
25. (7分)阅读下面科普短文。
维生素A是一种重要的营养素,具有抗氧化、调节免疫、促进生长发育等作用。维生素A只存在于动物体中,常见食物中维生素A的含量如表1所示。植物中虽不含有维生素A,但许多蔬菜、水果中含有胡萝卜素,它在小肠中可分解为维生素A。
表1 每100g食物中维生素A的含量
食物种类 | 羊肝 | 牛奶 | 鸡蛋 | 河蟹 | 黄鱼 |
维生素A含量( | 20972 | 24 | 310 | 389 | 10 |
维生素A是由C、H、O元素组成的黄色固体,不溶于水,易溶于乙醇;易被氧化,特别是暴露于氧气、高温环境时,会加快这种氧化作用。因此,食品加工、生产过程会影响食品中维生素A的含量。
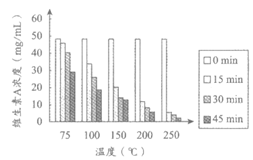
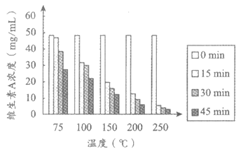
实验人员以不同原料为载体,模拟食品加工过程,研究了加工温度和加工时间对食品中维生素A含量的影响。实验过程中,先用维生素A标准溶液(溶剂为乙醇)对面粉进行强化处理,将处理后的面粉分别用水或鸡蛋清揉合成面团;再以此面团为研究对象,探究加工温度和加工时间对食品中维生素A含量的影响,测定结果如图1、2所示。
|
|
图1 温度和时间对维生素A浓度的影响 (以面粉+水为载体) | 图2 温度和时间对维生素A浓度的影响 (以面粉+蛋清为载体) |
因此,在食品加工生产的过程中,科学地控制温度、时间对食品中维生素A的保留至关重要。
(原文作者:宋凤艳等,有删改)
依据文章内容回答下列问题。
(1)维生素A的物理性质有__________(写出1条即可)。
(2)表1所列出的几种食物中,维生素A含量最高的是__________。
(3)从实验设计看,涉及到的影响食品中维生素A含量的因素有加工温度、加工时间和___________。
(4)根据图1得出的关于加工时间对食品中维生素A含量影响的结论是___________。
(5)图2中,得出关于加工温度对食品中维生素A含量影响的结论,所依据的证据是___________。
(6)下列说法正确的是___________(填序号)。
a. 维生素A是一种营养素
b. 维生素A中只含非金属元素
c. 维生素A能与氧气反应
d. 吃蔬菜对补充维生素A无益
【生产实际分析】
26. (4分)用冰铜(主要成分为FeS和Cu2S)为原料制备CuSO4的主要工艺流程如下:
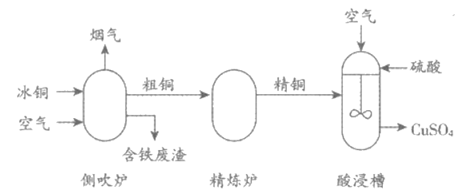
(1)冰铜属于__________(填“纯净物“或“混合物“)。
(2)侧吹炉中发生反应:Cu2S+O2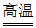 2Cu+SO2,该反应所属的基本反应类型是__________。
2Cu+SO2,该反应所属的基本反应类型是__________。
(3)配平酸浸槽中反应的化学方程式:□Cu+ 1 O2+□H2SO4===□CuSO4+□H2O
(4)酸浸槽中,搅拌的目的是________。
27. (3分)炼铜过程产生的烟气可用于制备硫酸,实现变废为宝,部分流程如下:
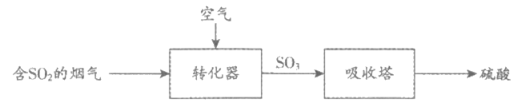
(1)SO2中,硫元素的化合价为________。
(2)转化器中发生的反应是化合反应,反应物是SO2和空气中的________。
(3)吸收塔中发生的是________(填“物理“或“化学“)变化。
【基本实验及其原理分析】
28. (4分)在实验室中制取CO2,并验证其性质。
(1)实验室制取CO2反应的化学方程式为________。
(2)下列装置中,制备、收集CO2的装置分别是________、________(填序号)。
(3)验证“CO2不支持燃烧“性质的实验操作:取一瓶收集好的CO2气体,________。
29. (4分)用下图装置进行CO2的性质实验。

(1)向澄清石灰水中通入CO2,观察到澄清石灰水变浑浊,产生该现象的原因是________(用化学方程式表示)
(2)向紫色石蕊稀溶液(由紫色石蕊和水配制而成)中通入CO2,观察到紫色溶液变红。
①上述实验________(填“能“或“不能“)得出“CO2可以和H2O发生反应“的结论,理由是________。
②加热该红色溶液,可观察到的现象是________。
30. (2分)分别将盛有白磷、红磷的试管放入盛有80℃热水的大烧杯中(如下图),验证可燃物燃烧的条件。
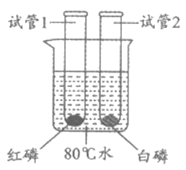
已知:白磷的着火点为40℃,红磷的着火点为240℃。
(1)实验过程中发现,试管1中红磷不燃烧,试管2中白磷燃烧,由此可验证的可燃物燃烧条件是________。
(2)验证可燃物燃烧的另一个条件,需继续进行的实验操作是________。
31. (5分)某兴趣小组同学进行如下图所示的2个实验。
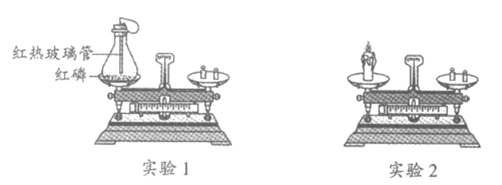
(1)实验1能验证质量守恒定律。
①红磷燃烧的化学方程式为_________。
②反应前称得质量为m1,红磷充分燃烧后冷却,称得质量为m2,m1______m2(填“>””=“或“<“)。
③从微观角度分析,化学反应一定符合质量守恒定律的原因是_________。
(2)实验2不能验证质量守恒定律,原因是_________。
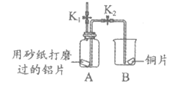
32. (5分)用下图装置研究铝和铜的化学性质。
实验装置 | 实验步骤 |
| I. 检查装置的气密性; Ⅱ. 打开K1,关闭K2,用注射器向A中注入过量稀硫酸,直至液面浸没A中右侧导管口; Ⅲ. 打开K2,关闭K1 |
(1)用砂纸打磨铝片的目的是________。
(2)检查装置气密性的操作:向B中加入蒸馏水至浸没导管口,关闭K1,打开K2,________。
(3)步骤Ⅱ,A中可以观察到的现象有________。
(4)步骤Ⅲ,A中液体进入B后,未观察到明显现象,原因是________。
【科学探究】
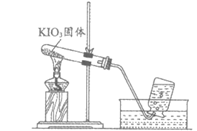
33.(8分)碘酸钾(KIO3)为白色固体,可溶于水,常作为补碘剂被添加到食盐中。小组同学实验探究其性质。
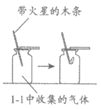
【进行实验1】用下图所示实验探究KIO3的热稳定性。记录如下:
序号 | 1-1 | 1-2 |
装置 |
|
|
现象 | 加热较长时间后,产生大量气泡 | 带火星的木条复燃 |
【解释与结论】
(1)实验1-1结束时,应进行的操作是先________,后________。
(2)1-2中现象说明,1-1中收集到的气体是________。
(3)由实验1可知,KIO3受热________(填“能“或“不能“)分解。
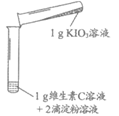
【进行实验2】按下表数据、用下图装置进行实验,探究KIO3与维生素C的反应及其影响因素,记录如下表。
资料:淀粉溶液遇I2变为蓝色,遇KIO3、维生素C(化学式为C6H8O6)、醋酸(化学式为C2H4O2)不变色。
装置 | 序号 | 溶液中溶质的质量/g | 实验现象 | |
KIO3 | 维生素C | |||
| 2-1 | 0.1 | 0.1 | 溶液立即由无色变为蓝色 |
2-2 | 0.005 | 0.005 | 溶液逐渐由无色变为蓝色 | |
2-3 | 0.0025 | 0.0025 | 一段时间后溶液无明显变化,再滴入5滴稀醋酸后,溶液逐渐变为浅蓝色 | |
【解释与结论】
(4)实验2-1中,KIO3溶液与维生素C溶液的溶质质量分数________(填“相等“或“不相等“)。
(5)对比实验2-1、2-2,可探究的影响KIO3与维生素C反应的因素是________。
(6)由上述实验得到结论“KIO3能与维生素C反应生成I2“,实验证据是________。
【反思与评价】
(7)甲同学由实验2-3得出结论:醋酸会促进KIO3与维生素C的反应;乙同学认为不严谨,理由是__________。
【生产实际定量分析】
34. (6分)砂子主要成分是二氧化硅(SiO2)人们以砂子为原料,先制成粗硅,然后提纯制成高纯硅,再用高纯硅制造集成电路。生产粗硅的化学反应如下:
2C+SiO2 Si+2CO↑
Si+2CO↑
(1)二氧化硅中,硅、氧原子个数比为________。
(2)生成的Si与CO的质量比为________。
(3)若所用砂子中SiO2的质量分数为60%,则:
①200t砂子中SiO2的质量为________t。
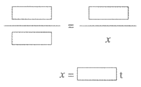
②请补全下列计算过程,求出用200t砂子理论上最多能生成的Si的质量。
解:设理论上最多能生成Si的质量为x。 2C + SiO2
答:理论上最多能生成Si的质量为__________t。 |
参考答案
第一部分
选择题
(每小题只有1个选项符合题意,共20个小题,每小题2分,共40分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | B | C | D | B | C | B | D | A | A | A |
题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
答案 | B | D | C | B | D | A | D | C | C | B |
第二部分
非选择题
评阅非选择题时请注意:
• 若无特别说明,每空1分。
• 文字表述题中其他答案合理也给分。
• 方程式中的产物多写、漏写“↑”或“↓”不扣分。
• 化学专用词汇若出现错别字为0分。
21.(4分)
(1)bc
(2)温室效应增强,全球气候变暖(或其他合理答案)
(3)①
石油
② CH4 + 2O2
 CO2 + 2H2O
CO2 + 2H2O
22.(2分)
(1)煮沸
(2)2H2O  2H2↑+ O2↑
2H2↑+ O2↑
23.(2分)
(1)使氧气更充足
(2)分子在不断运动
24.(4分)
(1)Fe2O3 + 3CO  2Fe + 3CO2
2Fe + 3CO2
(2)导热性
(3)Fe + CuSO4
==== FeSO4 + Cu
(4)刷漆(或其他合理答案)
25.(7分)
(1)黄色固体(或不溶于水,易溶于乙醇)
(2)羊肝
(3)原料载体
(4)其他条件相同时,加工时间越长,维生素A浓度越低(2分)
(5)加工时间相同时,不同加工温度下的维生素A浓度值
(6)abc
26.(4分)
(1)混合物
(2)置换反应
(3) 2 Cu + 1 O2 + 2 H2SO4 ==== 2 CuSO4 + 2 H2O
(4)使反应物充分接触,反应更充分
27.(3分)
(1)+4价
(2)氧气
(3)化学
28.(4分)
(1)CaCO3 + 2HCl ==== CaCl2 + CO2↑+ H2O
(2)②、③
(3)将燃着的木条伸入瓶中
29.(4分)
(1)CO2 + Ca(OH)2 ==== CaCO3↓+ H2O
(2)①
不能
没有证明“CO2不能使紫色石蕊变红”
②
有气泡产生,溶液由红色变为紫色
30.(2分)
(1)温度达到可燃物的着火点
(2)将1小块白磷放到盛有80 ℃热水的大烧杯中(或其他合理答案)
31.(5分)
(1)① 4P + 5O2
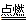 2P2O5
2P2O5
② =
③
反应前后原子种类、数目、质量均不改变
(2)蜡烛燃烧反应没有在密闭装置中进行,无法测得反应物O2和生成物CO2、H2O的质量(2分)
32.(5分)
(1)除去铝片表面的氧化膜
(2)用手捂住A
(3)产生大量无色气泡
(4)在金属活动性顺序中,Cu位于Al后、H后,因此,Cu既不能与稀硫酸反应,也不能与Al2(SO4)3反应(2分)
33.(8分)
(1)撤导管,撤酒精灯(共1分)
(2)O2
(3)能
(4)相等
(5)反应物的溶质的质量分数
(6)实验2-1、2-2中,溶液由无色变为蓝色(2分)
(7)可能是醋酸与KIO3反应生成了I2,使淀粉溶液变蓝
34.(6分)
(1)1:2
(2)1:2
(3)① 120
②
(共3分)
解:设理论上最多能生成Si的质量为x。 |
2C + SiO2 |
60 28 120 x (1分) |
60 28 ______ = _________
120 t x (1分) |
x= 56 t (1分) |
答:理论上最多能生成Si的质量为 56 t。 |


 Si + 2CO
Si + 2CO
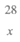
 Si + 2CO↑
Si + 2CO↑